שמעון דיין
מעלות
תשנ"ה, 1994
עמודי דפוס 9-300
העתיקה: אורלי שרף
הספריה המרכזית לעיוורים
ישראל 2018
העתקה או העברה של העותק המותאם בניגוד להוראות חוק התאמת יצירות, ביצועים ושידורים לאנשים עם מוגבלות התשע"ד - 2014, מהווה הפרה של זכות יוצרים.
*9*
*9*
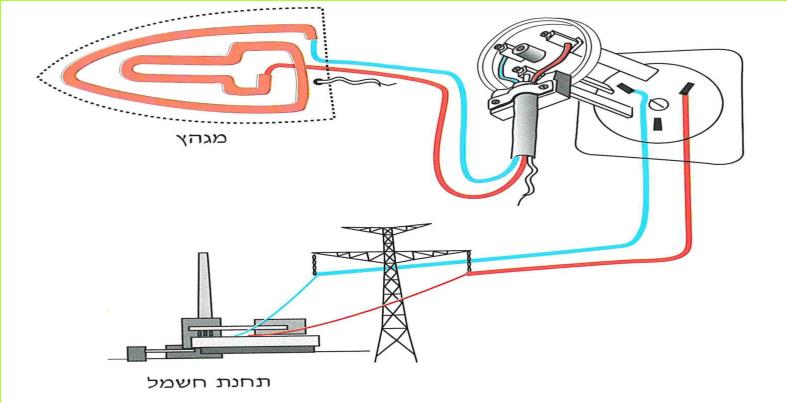
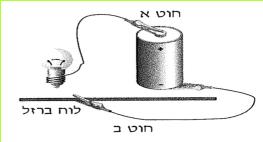
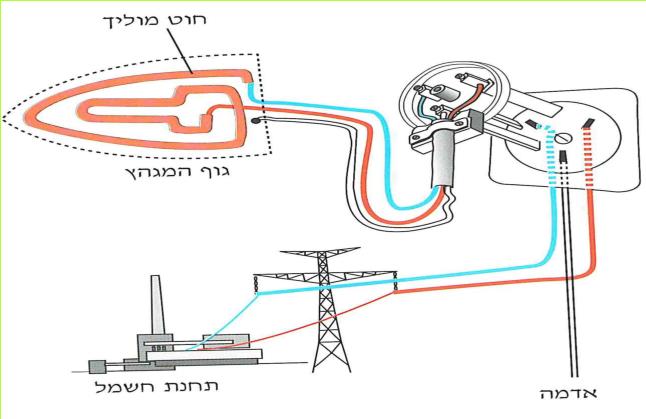
הזרם החשמלי מגיע לבתינו מ"תחנת החשמל". חוטי החשמל המתוחים בין עמודים לאורך הכבישים, על פני שדות והרים, הם אלה המחברים את בתינו אל "תחנת החשמל". ודאי ידוע לכם, כי מאחורי המתג ישנם חוטים, המחוברים אליו ואל בית הנורה, שבו נמצאת הנורה החשמלית. ישנם מכשירים כמו פנס כיס, רדיו-טרנסיסטור, שעון מעורר, מחשבון, המופעלים על ידי חשמל, בלי שיהיו קשורים לחוטים שמקורם ב"תחנת החשמל" מכשירים אלה מופעלים על ידי מקור זרם אחר - הסוללה החשמלית.
בניסויים נשתמש אך ורק בסוללה החשמלית.
ניסויים אלה בטוחים, ותוכלו לעשותם בלי חשש. אך זכרו, שימוש בלתי זהיר בחשמל הוא מסוכן מאוד. לעולם אל תעשו ניסויים בזרם החשמלי המגיע מ"תחנת החשמל".

*10*
בשנים קודמות למדתם כי כאשר המעגל החשמלי סגור הנורה מאירה וכאשר המעגל החשמלי פתוח הנורה אינה מאירה.
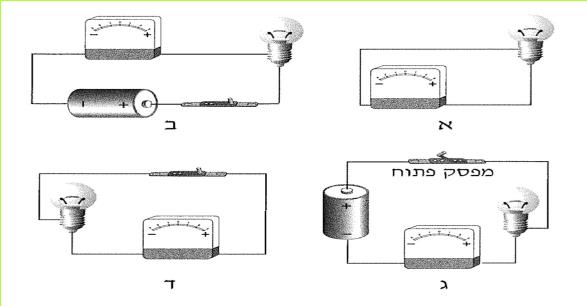
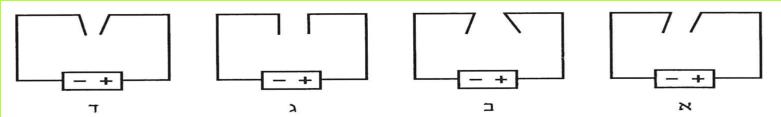
לפניכם מספר איורים (א-ו) המתארים חיבור נורה לסוללה.
(בספר ששה איורים, היעזר במנחה)
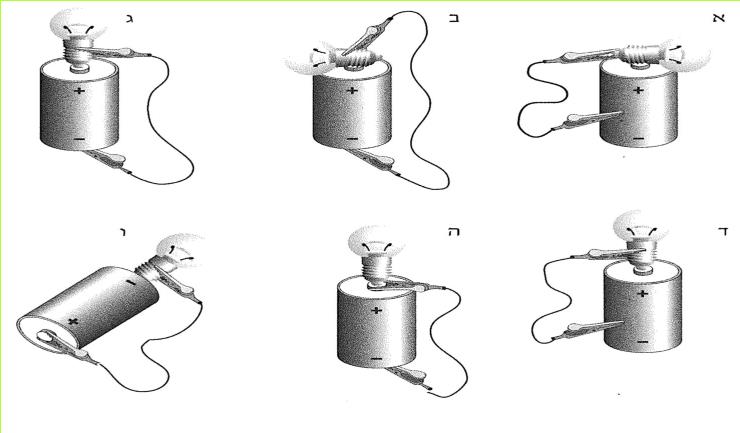
א. באילו חיבורים המעגל החשמלי סגור?
ב. באילו חיבורים המעגל פתוח? כיצד ניתן לסגור אותו? בדקו את תשובתכם בעזרת הציוד שלפניכם.
ג. מה המשותף לכל המעגלים הפתוחים המופיעים באיורים א-ו?
*11*
אסור לחבר במישרין הדק אחד של הסוללה להדק האחר. חיבור כזה מקצר את משך הזמן, שהסוללה יכולה לפעול.
(בספר שתי תמונות, היעזר במנחה)

*12*
אנו כבר יודעים, כי כאשר המעגל החשמלי סגור, הנורה מאירה. לחומרים, הסוגרים את המעגל החשמלי, קוראים מוליכים. לחומרים שאינם סוגרים את המעגל החשמלי קוראים מבדדים.
לפניכם שלושה איורים: א, ב, ג. כתבו במחברתכם, מהו התיקון הדרוש בכל אחד משלושת המעגלים, כדי שיחשב למעגל חשמלי סגור.
(בספר שלושה איורים, היעזר במנחה)
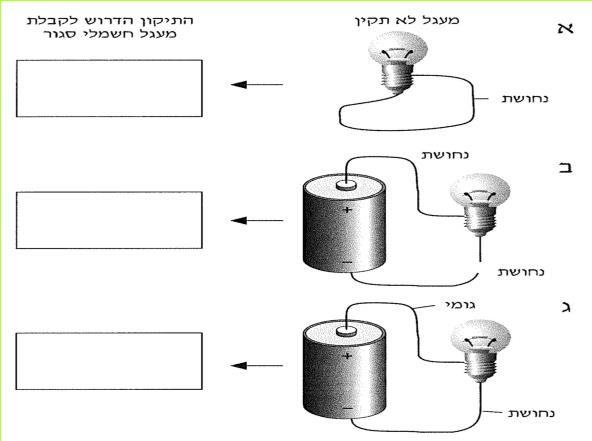
לאחר שראינו מה נחוץ בכל אחד משלושת המעגלים הלא תקינים, נוכל לקבוע את התנאים הנחוצים לקיומו של מעגל חשמלי סגור.
א. מעגל חשמלי סגור הוא רצף של מוליכים מהדק אחד של הסוללה למשנהו.
ב. רצף כזה מאפשר קיומן של תופעות חשמליות, כמו הופעת אור בנורה.
*13*
(בספר איור, היעזר במנחה)
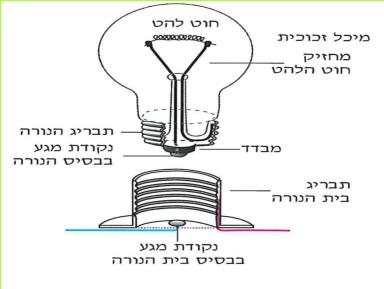
- נקודת מגע בבסיס בית הנורה
- תבריג בית הנורה
- נקודת מגע בבסיס הנורה
- מבדד
- תבריג הנורה
- מחזיק חוט הלהט
- חוט להט
- מיכל זכוכית
א. 1. לפניכם נורה ובית נורה, התבוננו בהם. היעזרו באיור שלפניכם.
2. אילו מחלקי הנורה ובית הנורה עשויים מחומרים מוליכים? אילו מהם עשויים מחומרים מבודדים?
ב. תארו כיצד נסגר המעגל החשמלי, כאשר הנורה מוברגת בתוך בית הנורה.
ג. כאשר נורה "נשרפת" - חוט הלהט נקרע. מדוע נורה "שרופה" אינה מאירה?
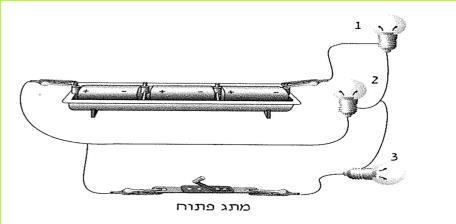
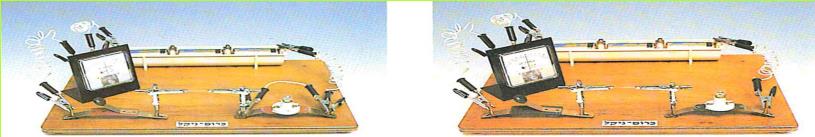
ישנו מכשיר נוח, שבעזרתו אפשר לסגור ולפתוח מעגלים חשמליים. מכשיר זה נקרא מתג חשמלי או מפסק.
לפניכם איור של מתג בעל מבנה פשוט. בקשו מהמורה מתג חשמלי והתבוננו בו היטב.
(בספר שני איורים, היעזר במנחה)
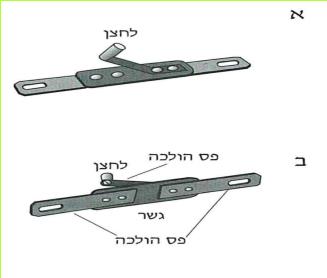
א. אילו מחלקיו עשויים מחומר מוליך? אילו מהם עשויים מחומר מבודד?
ב. מהו תפקידו של פס ההולכה?
ג. הסבירו כיצד ניתן לפתוח מעגל חשמלי על ידי המתג.
ד. נניח שנוצר מצב, שבו אין למורה די מתגים לחלק לכל תלמידיו. הציעו דרך פשוטה לבניית תחליף למתג.
*14*
ה. לפניכם תצלום של מתג קיר מאלה המצויים בחדרי מגורים. התבוננו במבנהו והסבירו את דרך פעולתו.
(בספר שתי תמונות, היעזר במנחה)

ו. לפניכם תצלום של מתג ביתי.
1. חלקי המתג סומנו במספרים. ציינו אילו הם מבדדים.
2. באיזה תצלום המתג פותח את המעגל החשמלי, א או ב? נמקו.
(בספר שתי תמונות, היעזר במנחה)

*15*
קשה לצייר בדייקנות את חלקיו של המעגל החשמלי: הנורה, בית הנורה, המתג והסוללה. האם ניסיתם לצייר מתג כפי שהוא נראה?
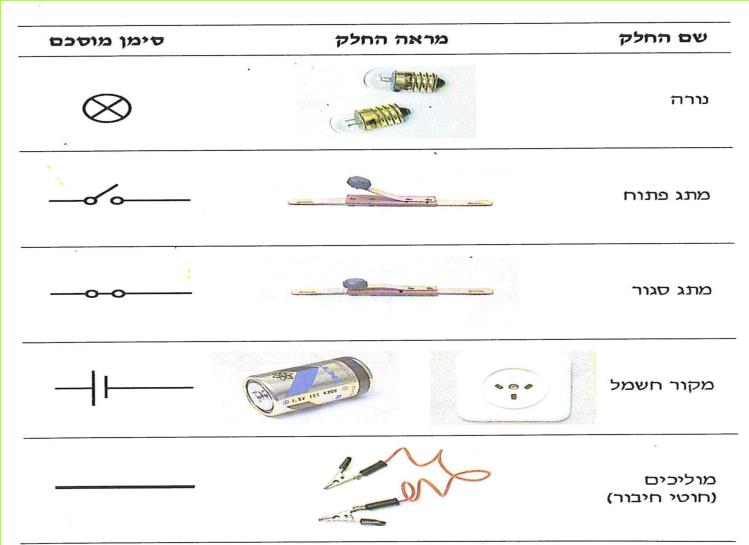
כדי להקל על ציור המעגלים החשמליים משתמשים בסימנים. לכל חלק מהמעגל - סימן פשוט שאפשר לציירו בקלות.
שם החלק | מראה החלק(בעמודה זו היעזר במנחה) | סימן מוסכם(בעמודה זו היעזר במנחה) |
נורה | ||
מתג פתוח | ||
מתג סגור | ||
מקור חשמל | ||
מוליכים (חוטי חיבור) |
*16*
א. העתיקו את הסימנים הבאים למחברתכם, כך שיתארו מעגל חשמלי.
(בספר סימנים, היעזר במנחה)
ב. האם התרשים, שציירתם, מתאר מעגל פתוח או סגור? נמקו!
ג. תלמיד הרכיב את המעגל החשמלי שבתרשים
(בספר איור, היעזר במנחה)
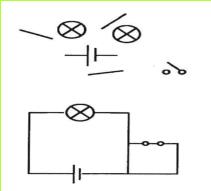
1. האם הנורה מאירה?
2. מה יקרה כאשר יפתח את המתג?
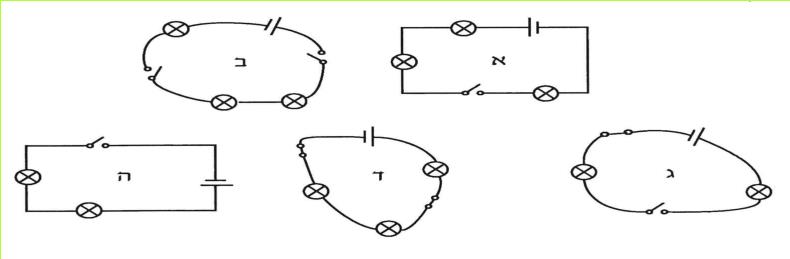
ד. לפניכם תצלום של מעגל חשמלי.
(בספר תמונה, היעזר במנחה)

חמישה תלמידים ציירו תרשימים של מעגל זה. לפניכם התרשימים שהם ציירו. איזה תרשים נכון?
(בספר חמישה איורים, היעזר במנחה)
*17*
אל תנסו לבדוק את המכשירים החשמליים הביתיים!
החשמל המגיע מ"תחנת החשמל" הוא מסוכן לאדם!
לפניכם תצלום של מכשירים חשמליים המצויים בשימוש ביתי.
התבוננו באופן חיבורם לשקע.
(בספר שלוש תמונות, היעזר במנחה)

מעיון בתמונות אלה עולות השאלות הבאות:
א. האם לא חסרים מוליכים למעגל החשמלי, שבו מצויים מכשירים אלה?
ב. כיצד נסגר המעגל החשמלי של המכשירים הללו?
*18*
כדי לענות על שאלות אלו התבוננו בתצלום של חוט חשמל המחבר מכשיר חשמלי אל השקע החשמלי בבית.
(בספר תמונה, היעזר במנחה)
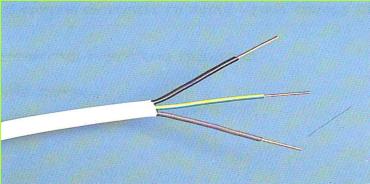
מבחוץ אכן נראה לנו חוט אחד, אך לאמיתו של דבר, מצויים בתוכו שניים או שלושה חוטים. חוט אחד מצופה במעטה חום (או אדום), חוט שני מצופה במעטה כחול (או שחור), חוט שלישי מצופה במעטה ירוק-צהוב. קצה אחד של החוט העטוף בציפוי חום (או אדום) והקצה של החוט העטוף בציפוי כחול (או שחור) - מחוברים דרך השקע אל תחנת החשמל.
(בספר שתי תמונות, היעזר במנחה)

הקצה האחר של החוטים מתחבר למכשיר החשמלי.
(על תפקידו של החוט השלישי, הצהוב-ירוק, תלמדו בקטע: "מנגנוני בטיחות להגנה מפני נזקי התחשמלות" בעמודים 73-77.
*19*
לפניכם תיאור מפורט של המעגל החשמלי:
(בספר איור, היעזר במנחה)
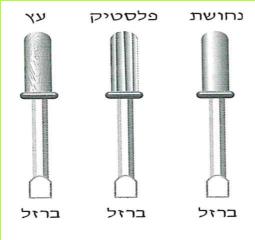
א. לפניכם שלושה מברגים. איזה מהם אינו בטיחותי לעבודות חשמל? נמקו.
- נחושת - ברזל
- פלסטיק - ברזל
- עץ - ברזל
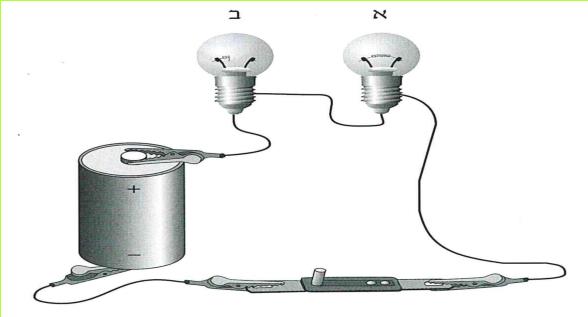
*20*
ב. תלמיד חיבר מוט זכוכית ומוט נחושת זה ליד זה בין שני הדקי "תנין" אנכיים. (ראו תצלום).
מה יקרה אם הוא יחבר את הדקי התנין לסוללה? האם המעגל יהיה סגור? הסבירו את תשובתכם.
(בספר תמונה, היעזר במנחה)

ג. האיור הבא מתאר מעגל, שיש בו שתי נורות, מתג וסוללה. נורה ב' "שרופה". האם נורה א' תאיר, כאשר ילחצו על המתג?
(בספר איור, היעזר במנחה)
ד. נניח שבניתם מעגל חשמלי, והנורה אינה מאירה. החלפתם את הנורה, ועתה הנורה החדשה מאירה. מה הייתה, לדעתכם, הסיבה, שהנורה הראשונה לא האירה? היכן הייתה התקלה?
ה. כאשר מפרקים פנס של אופניים רואים, שרק חוט אחד מוליך מבית הנורה אל הדינאמו (מקור הזרם), ובכל זאת הפנס מאיר. כיצד נסגר מעגל חשמלי זה?
(בספר תמונה, היעזר במנחה)

*21*
ו. לפניכם תרשים של מערכת שבה מחוברים ארבעה מתגים.
(בספר איור, היעזר במנחה)
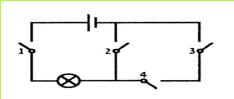
1. סוגרים את המתגים מס' 1 ו-2. האם הנורה תאיר?
2. סוגרים את המתגים מס' 1, 3 ו-4. האם הנורה תאיר?
3. סוגרים את המתגים מס' 2, 3 ו-4. האם הנורה תאיר?
ז. במעגל המתואר בתרשים נשרפה נורה אחת, וכתוצאה מכך כבו כל שאר הנורות. איזה נורה נשרפה?
(בספר איור, היעזר במנחה)
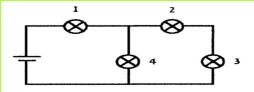
ח. לפניכם תרשימים של מספר מעגלים חשמליים. באילו מהם כל הנורות כבות, כאשר אחת הנורות במעגל נשרפת? נמקו.
(בספר 4 איורים, היעזר במנחה)
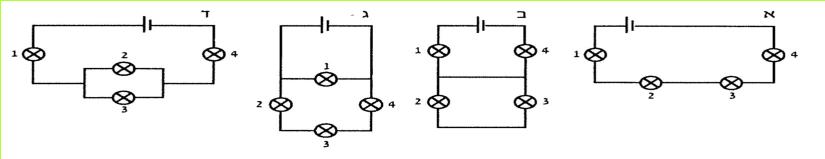
ט. התבוננו במעגל החשמלי שלפניכם.
האם המעגל החשמלי סגור? נמקו.
(בספר איור, היעזר במנחה)
*22*
י. לאחר ירידת גשמים עזים נקווים מים ומציפים דרכי עפר וכבישים. כאשר כלי רכב נוסעים בתוך שלולית עמוקה, יש חשש שיחדרו מים לצינור המפלט (אגזוז), והמנוע יכבה.
במצב זה המכונית עלולה להיתקע בתוך השלולית מבלי יכולת להתקדם.
לפניכם תרשים של מכשיר שנועד להזהיר את הנהגים מכניסה למים בעומק העולה על גובה צינור המפלט שברכב.
(בספר שני איורים, היעזר במנחה)
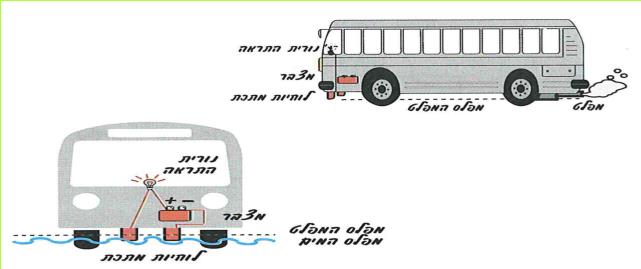
עיינו היטב באיור וענו על שאלות אלו:
1. הכינו תרשים של המעגל החשמלי המופיע באיור.
2. היכן פתוח המעגל החשמלי?
3. כיצד נסגר המעגל החשמלי?
4. מדוע לוחיות המתכת קבועות בגובה, הנמוך במקצת מגובה פתח צינור המפלט?
*23*
יא. כתבו ליד כל משפט "נכון" או "לא נכון":
1. כל החומרים בטבע מוליכים חשמל --.
2. קרטון סוגר מעגל חשמלי --.
3. במעגל חשמלי סגור הנורה אינה מאירה --.
4. כאשר חוט הלהט בנורה קרוע, הנורה אינה דולקת --.
5. נקודות החיבור של הנורה הן בסיס ותבריג --.
6. אלומיניום הוא חומר מוליך חשמל, לכן הוא סוגר מעגל חשמלי --.
7. לסוללה יש רק הדק אחד --.
8. מעגל חשמלי, שבו יש נורה "שרופה", הוא מעגל חשמלי סגור. --.
יב. האיור מתאר מעגל חשמלי, שבו הנורה מאירה. מה מיותר במעגל זה?
(בספר איור, היעזר במנחה)
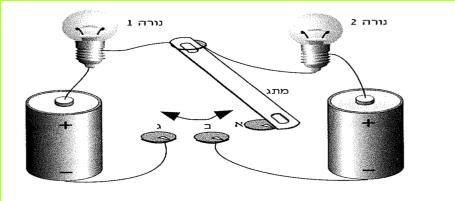
יג. אילו נורות מאירות במעגל המתואר באיור?
(בספר איור, היעזר במנחה)
יד. איזו נורה אינה מאירה? הסבירו מדוע.
*24*
טו. האיורים הבאים מתארים מעגלים חשמליים. איזה מבין המעגלים הוא פתוח? איזה סגור? הסבירו מדוע.
(בספר שני איורים, היעזר במנחה)
טז. האיור הבא מתאר מעגל חשמלי ובו שתי סוללות, שתי נורות ופס נחושת, שיכול לנוע בין הנקודות א, ב ו-ג.
(בספר איור, היעזר במנחה)
1. איזו נורה מאירה, כשהמתג נוגע בנקודה א'?
2. איזו נורה מאירה, כשהמתג נוגע בנקודה ב'?
3. איזו נורה מאירה, כשהמתג נוגע בנקודה ג'?
4. איזו נורה תאיר, אם נחבר את הנקודות א' וב' בחוט נחושת, והמתג יגע בנקודה א'?
*25*
יז. איתן רצה לבנות מתג. הוא לקח שני פסי נחושת, בנה את המכשיר המתואר באיור וחיבר אותו למעגל.
(בספר איור, היעזר במנחה)
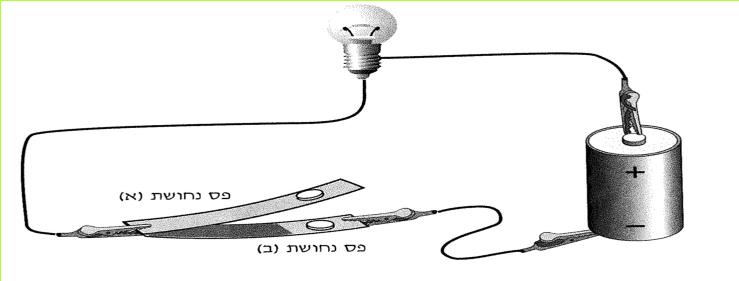
1. האם המעגל החשמלי, המתואר באיור, פתוח או סגור?
2. מה יקרה אם איתן ילחץ על פס א'?
3. למכשיר שבנה איתן אי אפשר לקרוא "מתג"? מדוע?
4. איזה שינוי יש לעשות במכשיר כדי להפוך אותו למתג?
יח' התבוננו בתרשים הבא:
(בספר איור, היעזר במנחה)
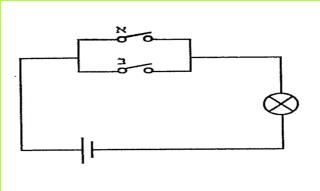
1. האם תאיר הנורה, כשנסגור את מתג א' בלבד?
2. האם תאיר הנורה, כשנסגור את מתג ב' בלבד?
3. האם תאיר הנורה, כשנסגור את שניהם?
*26*
בשאלות הבאות ובתשובותיהן מופיעים כמה מצבים, שבהם משתמשים לצרכים שונים בצורות חיבור שונות של מתגים.
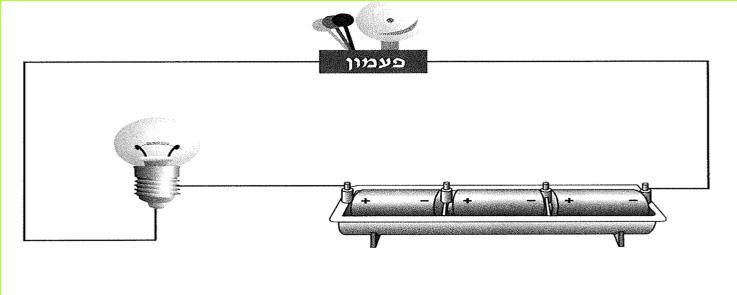
א. המנעול החשמלי של כספת בבנק בנוי כך שהוא נפתח רק כתוצאה מסגירת שני מתגים, הנמצאים בבנק בחדרים שונים ונתונים לביקורת של שני אנשים שונים. אי אפשר לפתוח את המנעול, כאשר מפעילים רק אחד מהמתגים. כיצד מחוברים ביניהם המתגים? תארו זאת בתרשים.
ב. לדירה שתי דלתות: דלת קדמית ודלת אחורית. כיצד יש לחבר מתגים, המפעילים פעמון חשמלי של הדירה, אם רוצים שהפעמון יופעל גם מן הדלת הקדמית וגם מן הדלת האחורית? נסו לסרטט זאת.
ג. מרכז הבקרה לא ישלח טיל לחלל, אלא לאחר שיקבל אישור מתחנות ביקורת אחדות. רק אחרי שכל תחנות הביקורת יאשרו את השילוח בסגירת מתג, תדלק במרכז הבקרה נורה המורה, כי הכול מוכן לשילוח. כיצד מחוברים המתגים של 5 תחנות ביקורת כאלה? נסו לסרטט זאת.
*27*
*27*
בחיי היום-יום אנו מרבים להשתמש במילה זרם, כגון: זרם מים, זרם אוויר, זרם מכוניות ואף זרם אנשים. במילה זרם אנו מתכוונים לתנועה של פרטים רבים בכיוון אחד.
(בספר שתי תמונות, היעזר במנחה)

*28*
בכל הזרמים שהזכרנו, אנו יודעים מהם הפרטים המהווים את הזרם: בזרם מים, אלה הם חלקיקי המים; בזרם אוויר, אלה הם חלקיקי הגזים השונים המרכיבים את האוויר.
גם לזרם החשמלי אנו יכולים להתייחס כזרם של פרטים. פרטים אלה הם חלקיקים זעירים ביותר בעלי תכונה חשמלית. אנו מכנים אותם בשם אלקטרונים.
האלקטרונים הם חלקיקים זעירים בהרבה מחלקיקי המים או מחלקיקי הגזים השונים המרכיבים את האוויר.
אין אנו יכולים לראות את זרם האוויר, ובכל זאת אנו יודעים, כי זהו זרם של חלקיקים המרכיבים את האוויר.
לדוגמה: רואים את השפעתו של זרם האוויר בעת פעולתה של השבשבת. בדומה לכך, אין אנו יכולים לראות את זרם האלקטרונים במוליכים, אך בכל זאת אנו יודעים, כי במוליכים זורמים אלקטרונים. אנו יכולים לראות את השפעתו של זרם האלקטרונים בעת פעולתה של הנורה החשמלית. כאשר זורמים בנורה אלקטרונים רבים בכל שנייה, הנורה מאירה באור חזק, וכאשר באותה הנורה ובאותם המוליכים זורמים פחות אלקטרונים בכל שנייה, הנורה מאירה באור חלש יותר.
*29*
*29*
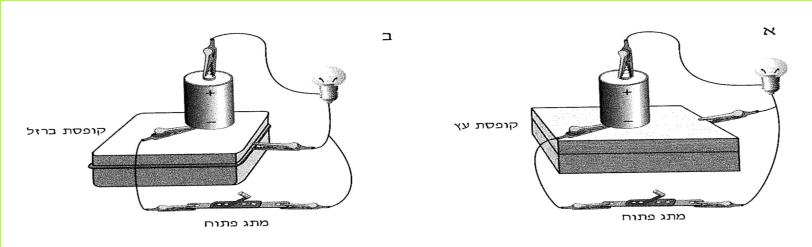
א. בנו מעגל חשמלי כמו המעגל המופיע בתצלום א.
לחצו על המתג והתבוננו בנורה.
(בספר שתי תמונות, היעזר במנחה)
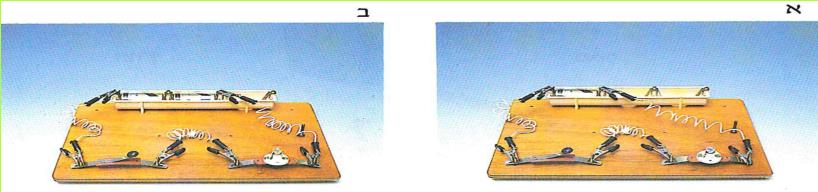
ב. הוסיפו סוללה למעגל כמו בתצלום ב'.
לחצו על המתג, והתבוננו בנורה.
1. האם הנורה האירה באותה עוצמה?
2. מה גרם להבדל בעוצמת האור במעגלים החשמליים שבניתם? הסוללה? הנורה? המתג? חוטי החיבור? נמקו!
3. עוצמת האור תלויה בגודל הזרם. האם, לדעתכם, גודל הזרם בשני המעגלים שבניתם היה שווה או שונה? נמקו!
4. האם אתם יכולים לקבוע, על פי עוצמת האור בנורה, כמה זרם עבר בכל אחד משני המעגלים?
בכיתה ז' למדתם, שלצורך מדידה של גודל כלשהו יש למצוא שיטה למדידה ואז:
א. בוחרים יחידת מידה.
ב. בונים מכשיר מדידה, שימדוד לפי יחידת המידה שנבחרה.
*30*
ג. עיינו באיור "יחידות מידה" והשלימו את החסר בעל פה.
הגודל | המכשיר (היעזר במנחה) | יחידת המידה |
אורך | מטר | |
טמפרטורה | מעלה | |
? | שניה | |
? | סמ"ק |
הגדלים, יחידות המידה ומכשירי המדידה שהזכרנו כאן, מוכרים לכם משנים קודמות. עתה נכיר גודל נוסף הנקרא: עוצמת הזרם.
(יש הנוהגים לקרוא לגודל זה בשם "גודל הזרם". אנו נשתמש בספר זה בשם: עוצמת הזרם.)
*31*
(בספר איור, היעזר במנחה)

(היחידה נקראת על שם אנדרה אמפר, פיסיקאי צרפתי שחקר לפני כ-150 שנה את תכונותיו של הזרם החשמלי.)
אפשר לומר: עוצמת זרם של אמפר אחד (מספר האלקטרונים העוברים כל שנייה דרך שטח החתך של מוליך שבו זורם זרם של 1 אמפר, הוא גדול מאוד. כאשר עובר זרם של 1 אמפר, זורמים בכל שנייה דרך שטח החתך במוליך 6,250,000,000,000,000,000 אלקטרונים בקירוב.)
עוצמת זרם של חצי אמפר.
עוצמת זרם של שלושה אמפר.
כדי למדוד את עוצמת הזרם אנו זקוקים למכשיר מדידה מתאים.
מכשיר זה נקרא מר זרם, ובלועזית אמפרמטר, על שם היחידה המבטאת את עוצמת הזרם - אמפר.
(בספר תמונה, היעזר במנחה)

*32*
*32*
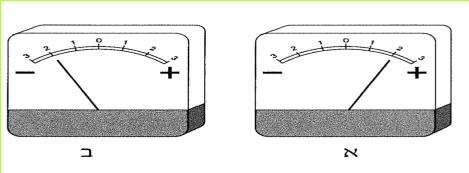
א. קבלו מהמורה אמפרמטר והתבוננו בו. על איזה מספר מורה המחוג, כאשר אין האמפרמטר מחובר למעגל החשמלי? מדוע? כאשר המחוג מורה על הספרה 1 בצד שמאל או בצד ימין, אנו יודעים שעוצמת הזרם במעגל היא 1 אמפר.
כאשר המחוג מורה על המספר 4. עוצמת הזרם היא 0.4 אמפר.
לסימנים + ו - המופיעים באמפרמטר אין כל משמעות חשבונית. זרם של 0.3 אמפר בצד ה - זהה לזרם של 0.3 אמפר בצד ה +.
ב. התבוננו בלוח המספרים שבאמפרמטר. מהי העוצמה הגדולה ביותר שאותה יכול למדוד האמפרמטר? (אל תשכחו לציין יחידות).
ג. מהי העוצמה הקטנה ביותר שאמפרמטר זה יכול למדוד?
ד. התבוננו בתצלומים א-ד משמאל.
1. מהי עוצמת הזרם שכל אמפרמטר מראה?
2. באילו מארבעת האמפרמטרים עובר זרם בעל אותה עוצמה?
3. על איזה מספר מצביע המחוג, כאשר לא עובר זרם דרך האמפרמטר?
4. האם במצב המתואר בשאלה הקודמת (מס' 3) עוברים אלקטרונים דרך המוליך?

*33*
(בספר שתח תמונות, היעזר במנחה)

א. העתיקו את הטבלה הבאה למחברת (שימו לב: אין כותרת לטור ד').
א | ב | ג | ד |
מספר הנורות במעגל | עוצמת האור בנורות (חזקה, בינונית, חלשה, אין אור) | האם עבר זרם במעגל? | -- |
נורה אחת | -- | -- | -- |
שתי נורות | -- | -- | -- |
שלוש נורות | -- | -- | -- |
*34*
(בספר שתי תמונות, היעזר במנחה)
ב. בנו מעגל חשמלי כמו המעגל המופיע בתצלום א'. סגרו את המעגל והתבוננו בעוצמת האור בנורה. רשמו את התוצאה בטבלה בעמודות ב' ו-ג'.
ג. הוסיפו למעגל הראשון נורה שנייה, ראו תצלום ב'. לחצו על המתג.
ד. התבוננו בנורות. האם חל שינוי בעוצמת האור? אם כן, מהו השינוי? רשמו את התוצאות בטבלה, בעמודות ב' ו-ג'.
ה. הוסיפו נורה שלישית למעגל. לחצו על המתג. התבוננו בנורות.
האם חל שינוי בעוצמת האור? האם הופיע בהן אור?
רשמו גם הפעם את התוצאות בטבלה.
ו. האם, לדעתכם, עבר זרם חשמלי במעגל השלישי? נמקו!
ז. כיצד ניתן לאמת את תשובתכם? הציעו ניסוי מפורט!
ח. לאחר שהמורה יסכים להצעת הניסוי שלכם, הוסיפו כותרת מתאימה לטור ד' בטבלה וערכו את הניסוי.
ט. על סמך הבדיקה שעשיתם, השלימו את החסר בטור ד' שבטבלה.
י. האם אי הופעת אור בנורה יכולה להעיד תמיד, שזרם חשמלי אינו עובר במעגל? נמקו!
יא. במה שונה מדידת הזרם באמפרמטר מההתרשמות מעוצמת האור בנורה?
*35*
*35*
מכשיר חשמלי פועל, רק כשהוא מחובר למעגל חשמלי סגור. לאחר חיבור המכשיר למעגל זורמים אלקטרונים דרך המוליכים של המכשיר ומפעילים אותו:
הנורה תאיר, התנור החשמלי יתחמם, והמנוע החשמלי יסתובב.
האם מספר האלקטרונים, הזורמים במעגל החשמלי, פוחת בעקבות הפעלת המכשיר החשמלי?
ניתן להעלות שתי השערות:
(בספר איור, היעזר במנחה)
א. מספר האלקטרונים במעגל פוחת בעקבות הפעלת המכשירים החשמליים.
ב. מספר האלקטרונים אינו משתנה בעקבות הפעלת המכשירים החשמליים.
באיזה השערה מבין השתיים אתם בוחרים? מדוע?
כיצד נכריע בין שתי ההשערות? נוכל לעשות זאת על ידי ניסוי.
עלינו להשוות את עוצמת הזרם משני צדדיה של נורה חשמלית.
א. הציעו שיטה, שבעזרתה תוכלו להשוות את הזרם משני צדי הנורה החשמלית.
ב. הכינו תרשים של המעגל החשמלי, שישמש אתכם לבדיקת ההשערה.
ג. רשמו את התוצאות.
ד. מהי מסקנתכם? האם עוצמת הזרם בצד אחד של הנורה שווה לעוצמת הזרם בצדה האחר?
ה. האם התוצאה תומכת בהשערה שבחרתם?
אומנם הוכחנו, כי הנורה אינה מבזבזת אלקטרונים, והזרם העובר דרך הנורה אינו משתנה. אך ייתכן כי ישנם מכשירי חשמל אחרים, שאכן מבזבזים אלקטרונים. כדי לבדוק טענה זו נשווה בעבודה הבאה את הזרם משני הצדדים של מכשירי חשמל שונים.
*36*
בעבודה זו נבדוק מכשירי חשמל שונים, כמו: טרנזיסטור, ווקמן, שעון מעורר חשמלי, מנוע חשמלי.
א. הציעו שיטה, שבעזרתה תוכלו לקבוע, מהו הזרם בשני צדדיו של אחד ממכשירי החשמל המופיעים ברשימה שציינו כאן.
ב. העתיקו את הטבלה הבאה ורשמו בה את תוצאות הניסויים שנערוך.
המכשיר שנבדק | הקריאה באמפרמטר הניצב לפני המכשיר החשמלי | הקריאה באמפרמטר הניצב אחרי המכשיר החשמלי | צריכת הזרם על ידי המכשיר החשמלי הנבדק |
ווקמן | |||
טרנזיסטור | |||
מנוע חשמלי | |||
שעון חשמלי מעורר |
ג. עיינו בתוצאות הרשומות בטבלה.
1. כמה זרם צרך ה"ווקמן"?
2. כמה זרם צרך ה"טרנזיסטור"?
3. כמה זרם צרך המנוע החשמלי?
4. כמה זרם צרך השעון החשמלי המעורר?
5. מהי המסקנה העולה מתוצאות הבדיקות של מכשירי החשמל, הרשומות בטבלת הסיכום?
6. האם מסקנה זו דומה למסקנה, שהעליתם לגבי הנורה החשמלית?
לאור המסקנות שעלו מתוצאות הניסויים שעשינו, ודאי מתעוררת אצלכם השאלה: עבור מה אנו משלמים לחברת החשמל?
תשובה לכך תוכלו לקרוא בעמוד 41, לאחר שתלמדו את הנושא: מהו מקור האלקטרונים במעגל החשמלי?
*37*
- הזרם החשמלי במוליך מוצק הוא זרם של אלקטרונים.
- זרם בעל עוצמה גדולה פירושו שמספר רב של אלקטרונים עובר בכל שנייה דרך שטח החתך של המוליך.
- מכשירים חשמליים אינם מבזבזים אלקטרונים.
*37*
עבודה י"א - תפקיד הסוללה
א. התבוננו בתצלום שלפניכם. האם במעגל כזה יעבור זרם חשמלי? מדוע?
(בספר תמונה, היעזר במנחה)

ב. 1. איזה מרכיב צריך להוסיף כדי שיעבור זרם אלקטרונים במעגל?
2. בנו מעגל כמו זה המופיע בתצלום. הוסיפו את המרכיב החסר. האם עתה עובר זרם חשמלי במעגל? כיצד אתם יודעים זאת?
3. מניסוי זה אנו למדים, כי בלא סוללה אין זרם חשמלי במעגל. מאחר שאנו כבר יודעים, כי זרם חשמלי הוא זרם אלקטרונים, ניתן לשער שמקור האלקטרונים הזורמים במעגל החשמלי הוא בסוללה. אפשר להעלות גם השערה אחרת: האלקטרונים הזורמים במעגל החשמלי נמצאים במוליכים, ותפקיד הסוללה לגרום לזרימתם במוליך.
*38*
1. הסוללה היא מקור האלקטרונים הזורמים במעגל החשמלי. כלומר:
הסוללה מספקת אלקטרונים - נוצר זרם חשמלי
2. האלקטרונים נמצאים במוליכים. תפקיד הסוללה לגרום לזרימתם במעגל. כלומר:
מוליך ובו אלקטרונים + סוללה - נוצר זרם חשמלי
מהניסויים שעשינו עד כה לא נוכל להחליט, איזו משתי ההשערות היא הנכונה. לשם כך עלינו לעשות ניסוי, שיגלה לנו:
האם האלקטרונים, שזורמים במעגל החשמלי, נמצאים כמוליכים?
ג. קחו סליל וחברו את שני קצותיו, בעזרת שני מוליכים, אל מיקרו-אמפרמטר (מד זרם רגיש לזרמים חלשים), כפי שרואים בתצלום הבא:
(בספר תמונה, היעזר במנחה)

1. האם במעגל זה מחוברת סוללה?
2. האם במצב זה עובר זרם חשמלי במעגל?
מנין לכם?
*39*
ד. קחו מגנט חזק בצורת מוט והכניסו אותו בתנועה מהירה לתוך סליל, כמתואר בתצלום א?
(בספר שתי תמונות, היעזר במנחה)
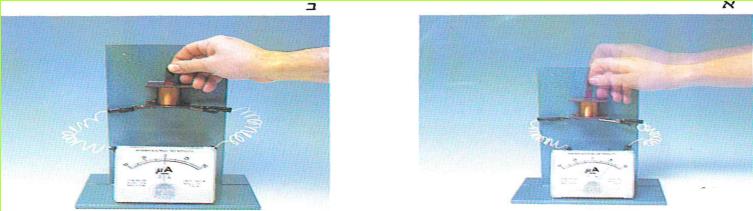
1. במה הבחנתם?
2. על מה מעידה תופעה זו?
3. האם בשעה שהמגנט ניצב בתוך הסליל ללא תנועה, עובר זרם חשמלי במעגל?
4. האם, לדעתכם, יש קשר בין הנעת המגנט בתוך הסליל ובין תגובת המיקרו-אמפרמטר? נמקו!
5. האם הסוללה מספקת את האלקטרונים במעגל, או שהם קיימים כל הזמן במוליכים? את תשובתכם בססו על התוצאות, שנתקבלו בסעיף ד' של העבודה.
ה. החליפו את המיקרו-אמפרמטר בנורה, וחזרו שוב על סעיף ד'.
(בספר תמונה, היעזר במנחה)

האם תנועת המגנט בתוך הסליל גרמה להופעת אור בנורה?
מהי הסיבה לכך?
*40*
נציג לפניכם מחולל זרם (דינאמו).
(בספר תמונה, היעזר במנחה)

חלקיו העיקריים הם:
1. גלגל הנעה
2. סליל העשוי מחוט נחושת מבודד
3. מגנט
4. נורה
נסובב את גלגל ההנעה במהירות.
א. האם הופיע אור בנורה?
ב. האם, לדעתכם, עובר זרם חשמלי במוליכים?
העלנו שתי השערות בדבר תפקיד הסוללה:
השערה א': הסוללה מספקת אלקטרונים למעגל החשמלי, ולכן ללא סוללה אין זרם חשמלי במעגל.
השערה ב': האלקטרונים מצויים במוליכים. תפקיד הסוללה לגרום לזרימתם במעגל.
ג. על פי התוצאות שהתקבלו בניסוי, איזו השערה היא הנכונה? נמקו.
*41*
ד. אילו חלקים במחולל מילאו תפקיד דומה לזה של הסוללה? הסבירו.
ה. איזו פעולה בעבודה י"א מקבילה לסיבוב הגלגל של המחולל?
ו. בעבודה י"א הנורה לא האירה, ואילו בעבודה י"ב הופיע אור בנורה. מהי הסיבה להבדל?
מניסוי ההדגמה ומהניסוי שעשיתם ניתן ללמוד כי:
א. אפשר להפיק זרם חשמלי גם ללא סוללה.
ב. האלקטרונים הזורמים במוליכים מקורם במוליכים עצמם.
תפקיד הסוללה הוא כתפקידו של המגנט והסליל בניסוי שערכתם. גם הסוללה וגם תנועת המגנט בתוך סליל גורמים לאלקטרונים לזרום במעגל החשמלי.
תפקיד הסוללה ותפקיד הדינאמו (מחולל זרם) הוא לגרום לאלקטרונים שבמוליכים לנוע בכיוון אחד במעגל החשמלי.
אנו יודעים כי: א. המכשירים החשמליים אינם מבזבזים אלקטרונים.
ב. מקור האלקטרונים במוליכים עצמם.
מכאן ברור, שאין אנו משלמים עבור האלקטרונים הזורמים כמוליכים. אנו משלמים עבור הזרמתם של האלקטרונים בחוטי החשמל.
כדי שהאלקטרונים יזרמו כמוליכים, ראינו שיש צורך להזיז מגנט בתוך סליל. בכיתה עשינו זאת ידנית, אבל כדי ליצור זרם חשמלי בעל עוצמה גדולה יש צורך בהנעת מגנטים רבי עוצמה. לשם כך מפעילים מחוללי זרם גדולים הנקראים גנרטורים. הגנרטור מופעל על ידי בערה של דלק. חברת החשמל קונה את הדלק, את הגנרטורים וכדומה. אנו משלמים מדי חודש לצורך כיסוי ההוצאות הכרוכות ברכישות הדלק להפעלת תחנות החשמל, ולצורך אחזקתן.
הרחבה: פרק קריאה - מיכאל פאראדיי והדינאמו ראו בעמודים 81-38.
הרחבה: פרק קריאה - תחנות החשמל לסוגיהן, ראו בעמודים 84-92.
*42*
- יחידת המידה של הזרם החשמלי נקראת אמפר.
- אמפרמטר הוא מכשיר למדידת עוצמת הזרם.
- כאשר נורה מאירה באור חזק יותר, עובר דרכה זרם בעל עוצמה גדולה יותר.
*42*
בכיתה ז' מיינו את החומרים השונים לשתי קבוצות גדולות:
1. חומרים המעבירים זרם חשמלי - מוליכים.
2. חומרים שאינם מעבירים זרם חשמלי - מבדדים.
נשאלת השאלה: האם כל החומרים הנקראים מוליכים מעבירים זרם חשמלי במידה שווה? לבירור שאלה זו נשתמש באמפרמטר.
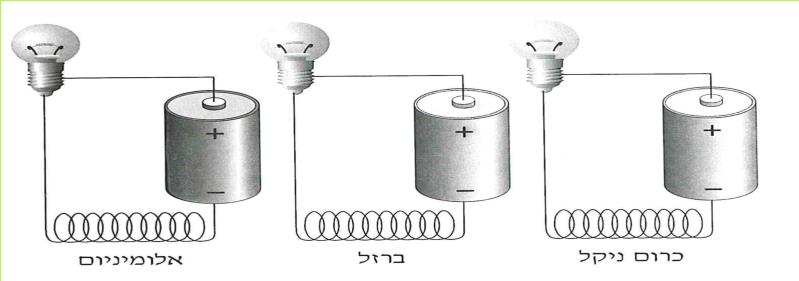
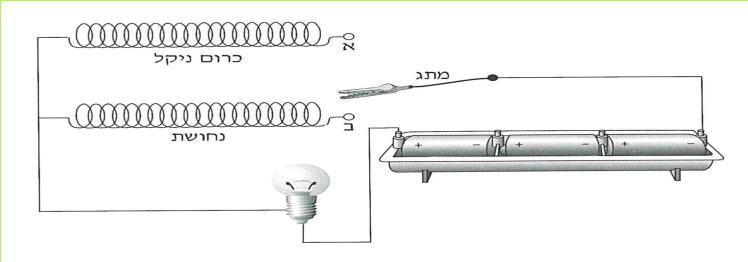
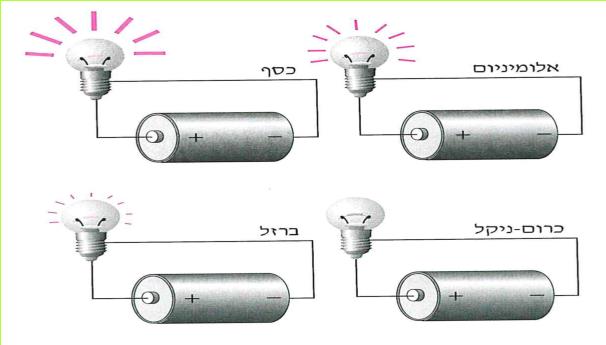
א. קבלו מהמורה שני סלילים המוליכים זרם חשמלי: אחד עשוי מנחושת ואחד עשוי מכרום ניקל. (כרום ניקל: מסג מתכתי העשוי מהמתכות כרום וניקל.) החוטים יהיו שווים באורכם ובשטח החתך שלהם. לפניכם שלוש השערות:
1. הנחושת והכרום ניקל מעבירים זרם חשמלי במידה שווה.
2. הנחושת מעבירה את הזרם החשמלי טוב יותר מהכרום ניקל.
3. הכרום ניקל מעביר את הזרם החשמלי טוב יותר מהנחושת.
תכננו ניסוי שבעזרתו תוכלו לקבוע איזו משלוש ההשערות היא הנכונה. לשם כך:
1. כתבו את מטרת הניסוי.
2. פרטו את הציוד הדרוש לכם.
3. תארו את מהלך הניסוי וערכו אותו.
4. רשמו את התוצאות.
5. איזו השערה אומתה?
בדרך זו נבדקו עוד חוטים רבים, העשויים מחומרים שונים, כמו: ברזל, אלומיניום, כסף, זהב, ועוד. נמצא, שהם מעבירים זרם חשמלי במידה שונה.
*43*
- מוליכות טובה
כסף
נחושת
זהב
אלומניום
ניקל
כספית
ברזל
עופרת
כרום ניקל
פחמן
- מוליכות גרועה
ב. לפניכם שלושה מעגלים השווים בכל, פרט לחומר שממנו עשוי קטע אחד של כל מוליך.
1. באיזה מעגל תאיר הנורה באור החזק ביותר?
2. איזה חומר מעביר את הזרם בעוצמה הקטנה ביותר?
(בספר שלושה איורים, היעזר במנחה)
*44*
ג. התבוננו באיור הבא.
1. לאיזו נקודה (א או ב) צריך לחבר את המתג, כדי שאור הנורה יהיה חזק יותר? נמקו את תשובתכם!
(בספר איור, היעזר במנחה)
העמקה: מדוע עוצמת הזרם משתנה, כאשר מחברים במעגל מוליכים העשויים מחומרים שונים? ראו בעמודים 54-57.
*45*
*45*
הופעת האור במעגלים החשמליים שבניתם, שימשה לנו כאחד הסימנים החיצוניים למעבר זרם חשמלי במעגל החשמלי. תופעת האור אינה התופעה היחידה המלווה את הזרם החשמלי. קיימות תופעות נוספות, ואחת מהן היא עליית הטמפרטורה של המוליכים במעגל החשמלי.
א. הרכיבו מעגל חשמלי ובו נורה, שלוש סוללות וחוטים.
הדליקו את הנורה למשך 2 דקות בקירוב.
לאחר מכן געו בנורה באצבעותיכם.
1. מה הרגשתם? נמשיך לחקור תופעה זו.
(בספר שתי תמונות, היעזר במנחה)

ב. קחו חוט כרום ניקל דק שאורכו כ-15 ס"מ ותפסו את קצהו האחד באטב. את הקצה האחר של החוט חממו בעזרת להבה.
התבוננו בקצה החוט שבלהבה.
איזה שינוי חל בקצה החוט?
הפסיקו את החימום וכבו את מבער הגז.
ג. חברו אל מהדק תנין חוט כרום ניקל, הדומה לזה שחממתם במבער הגז. במרחק של כ-2 ס"מ חברו לחוט את מהדק התנין השני. סגרו את המעגל (ראו תצלום).
1. תארו מה הבחנתם.
במה דומה התהליך הזה לחימום חוט בלהבת המבער?
2. מה גרם הפעם להתחממות חוט הנחושת?
3. איזו תופעה מופיעה ראשונה בין השתיים: התלבנות חוט הלהט או התחממותו?
ד. החליפו את החוט הדק בחוט כרום ניקל עבה יותר. סגרו את המעגל כפי שעשיתם בסעיף ג?
1. האם גם הפעם החוט התלהט?
2. מהי ההשפעה שיש לעובי של החוט על הטמפרטורה בשעה שעובר בו זרם?
*46*
מעבר זרם במוליך מתכתי גורם תמיד להתחממות המוליך. האלקטרונים, המהווים את הזרם החשמלי, מתנגשים באטומים שמהם עשוי המוליך והטמפרטורה של המוליך עולה. במרבית המקרים החום שנוצר מתפזר לסביבה, ואין חשים בעליית הטמפרטורה של המוליכים. במכשירים שלהפעלתם נדרש זרם גדול, עליית הטמפרטורה של המוליכים מהירה יותר ומורגשת יותר (לדוגמה: מקדחה, מאוורר, מכשיר טלוויזיה). עליית הטמפרטורה במעגל החשמלי הינה תופעה רגילה. בדרך כלל, עליית הטמפרטורה של המוליכים אינה מגיעה לכדי התלהטותם. זאת מכיוון שמשתמשים במוליכים המותאמים לגודל הזרם, שמתוכנן לעבור דרכם: לזרמים קטנים מוליכים דקים ולזרמים גדולים מוליכים עבים. אבל כאשר זרם גדול עובר בחוט דקיק - החוט מתלהט, כפי שקרה בניסוי שלנו עם חוט הכרום ניקל הדק.
א. מדוע חוטי החשמל (מוליכים), העוברים בתוך קירות הבית, עבים מאוד לעומת חוטי הלהט שבנורות המאירות את בתינו?
ב. אילו התקינו בקירות חוטים דקיקים מאוד, ובנורות חוטים עבים - מה, לדעתכם, היה יכול לקרות?
עד כה עסקנו בתופעת ההתחממות כתופעה נלווית לזרם החשמלי (לאדם המשתמש במכשיר החשמלי אין כל עניין וצורך בהתחממות זו של המוליכים).
א. האם אתם מכירים מכשירים, שבהם נעשה שימוש בתופעת החימום של החשמל? מנו אחדים מהם.
ב. לפניכם תצלום מקרוב של תנור חימום חשמלי.
1. האם בכל חלקי המתכת של התנור עובר זרם חשמלי?
(בספר שתי תמונות, היעזר במנחה)

*47*
2. מדוע אפשר לגעת בחלקי המתכת של התנור בלא חשש להתחשמלות?
3. לפעמים מסרגה ממתכת עלולה ליפול ולגעת בסליל של גוף החימום.
במצב כזה קיימת סכנת התחשמלות. מדוע?
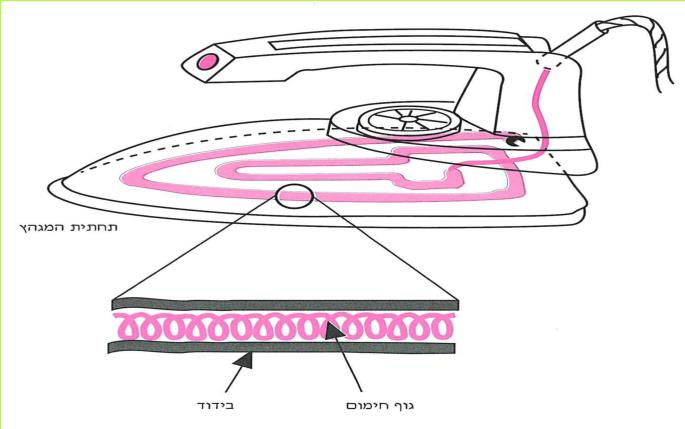
ג. התבוננו בתרשים המגהץ. החלקים האדומים מסמלים את גוף החימום של המגהץ.
1. זהו את חלקי המגהץ, העשויים חומרים מוליכים, ואת החלקים העשויים חומרים מבודדים. האם בכל חלקי המתכת של המגהץ עובר זרם, כשהמגהץ בפעולה?
2. מאיזה חומר עשויה ידית המגהץ? מדוע?
(בספר איור, היעזר במנחה)
*48*
ד. לפניכם תצלום של חמם המצוי בקומקום חשמלי.
1. מה תפקידו של החמם?
2. האם במים הנוגעים בו עובר זרם חשמלי? מדוע?
(בספר תמונה, היעזר במנחה)

*48*
חוט הלהט, כשמו כן הוא: החלק שמתלהט ומפיץ את האור בנורה. חוט הלהט עשוי מחומר בעל מליכות טובה. כשזרם חשמלי עובר בחוט להט, האלקטרונים, המהווים את הזרם החשמלי, מתנגשים באטומים, שמהם בנוי החוט. כתוצאה מהתנגשויות אלה עולה הטמפרטורה של חוט הלהט. עליית הטמפרטורה כה רבה, עד שהחוט מתלהט, מתלבן ומפיץ אור רב.
*49*
חומר מלובן - חומר מתכתי הנמצא בטמפרטורה גבוהה מאוד, הקרובה לטמפרטורת ההיתוך שלו. במצב זה החומר מקרין אור לבן.
ודאי תשאלו: מדוע אין המוליכים האחרים שבמעגל החשמלי מתלבנים ומפיצים אור? הרי גם הם עשויים מחומרים בעלי מוליכות חשמלית טובה, בדיוק כמו חוט הלהט?
הסיבה להבדל בעליית הטמפרטורה נובעת מההבדל בעובי המוליך. ככל שחוט המוליך דק יותר, כך הטמפרטורה עולה יותר. לכן חוט הלהט עשוי מחוט דק מאוד, ואילו שאר המוליכים שבמעגל עשויים מחוטים עבים יותר.
משתמשים במתכת טונגסטן לייצור חוטי הלהט. יסוד מתכתי זה נבחר כי טמפרטורת ההיתוך שלו גבוהה מאוד בהשוואה למתכות אחרות, ולכן אין הוא ניתך בטמפרטורת ההתלהטות שלו בנורה.
אחד מחסרונותיה של נורת הליבון הוא משך הזמן הקצר של "חיי" הנורה.
בגלל הטמפרטורה הגבוהה של חוט הלהט מתנדפים ממנו אטומים של המתכת, שממנה הוא עשוי. החוט הולך ונעשה דק ולבסוף הוא נקרע. מצב זה נהוג לכנות "נורה שרופה". לפעמים ניתן לראות את ציפוי אטומי המתכת על גבי הדופן הפנימית של מיכל הזכוכית, בצורת כתם שחור. כדי להתגבר על חסרון זה וכדי להגביר את עוצמת האור של נורת הליבון, הוכנסו שינויים במבנה הנורה. על שינויים אלה תוכלו לקרוא בקטע "כדאי לדעת", העוסק בפעולתה של נורת הלוגן, בעמודים 208-209.
על פעולתה של נורת התפרקות (נורת ניאון, נורת פלואורסצנט), תוכלו לקרוא בעמודים 138-139.
*49*
עד כה היכרנו שתי תופעות המלוות את הזרם החשמלי - אור וחום. בעזרת שתי תופעות אלה יכולנו לדעת, אם זורם חשמל במעגל. בשיעורים הבאים נכיר תופעה נוספת של החשמל; תופעה זו היא המגנטיות.
*50*
לפניכם מצפן. המצפן בנוי ממחוג דק, המחודד בשני קצותיו ומורכב על ציר, באופן שהוא יכול להסתובב. למחוג זה אנו קוראים מחט המצפן והוא נתון בתוך קופסה. פתחו את הקופסה והוציאו את המחט בזהירות, בעזרת מלקטת. המחט המסתובבת שבמצפן היא מגנט.
(בספר תמונה, היעזר במנחה)

א. הוכיחו זאת! כיצד בדקתם?
ב. החזירו את המחט למקומה וסגרו את הקופסה. הרחיקו את כל גופי הברזל או המגנטים שבקרבת הקופסה. לאיזה כיוון פונה המחט? האם גם אצל חבריכם פונה המחט לאותו הכיוון?
ג. עתה נסו לקרב מגנט אל מחט המצפן. סובבו את המגנט סביב המצפן. תארו מה קורה למחט המצפן. האם כיוון המחט מושפע מן המגנט?
ד. הרחיקו לאט את המגנט מן המצפן וקרבו אותו שוב. במה אתם מבחינים? האם השפעת המגנט על המחט תלויה במרחק שביניהם? כיצד?
ה. כאשר אין בסביבת המצפן מגנט או גוף ברזל כלשהו, המחט פונה תמיד לכיוון מסוים אחד. כיצד אפשר להסביר זאת?
ו. כאשר רוצים להשתמש במצפן כדי למצוא כיוון על-פני כדור הארץ, חייבים להרחיק מסביבתו מגנטים או גופים מברזל. הסבירו מדוע.
*51*
בעבודה הקודמת הכרתם את המחט המגנטית המסתובבת (המצפן). בעבודה זו נשתמש במצפן כדי לגלות זרם חשמלי.
(בספר שתי תמונות, היעזר במנחה)


א. קחו חוט חשמל והניחו אותו מעל למצפן, באופן שהחוט המונח על קופסת המצפן יהיה מקביל למחט המצפן, כמתואר בתצלום.
ב. את קצות החוט חברו אל סוללה. חברו גם מתג במעגל. סגרו לרגע את המתג והתבוננו במחט המצפן. במה אתם מבחינים?
ג. לפפו 6-8 ליפופים סביב קופסת המצפן (ראו תצלום).
הקפידו גם הפעם, שהמחט תהיה מקבילה לחוטים המלופפים. סגרו את המתג.
במה אתם מבחינים?
ד. כיצד משפיע זרם החשמל על מחט המצפן?
ה. במה דומה השפעת זרם החשמל להשפעת המגנט על המצפן?
ו. האם השפעת זרם החשמל על מחט המצפן משתנה, כאשר מגדילים את מספר הליפופים?
*52*
לפפו חוט חשמל על בורג ברזל או על מסמר ברזל גדול. השתמשו בחוט המבודד על-ידי שכבת צבע שקופה. הקפידו ללפף יפה, בסדר מדויק, ליפוף ליד ליפוף. כך תקבלו סליל. בשני קצות הסליל השאירו חוט באורך של 30 ס"מ. חשפו את קצות החוט בעזרת נייר זכוכית.
המכשיר שבניתם נקרא: אלקטרו-מגנט. הוא עשוי מסליל שבתוכו גרעין-ברזל.
(בספר שלוש תמונות, היעזר במנחה)



בנו מעגל חשמלי, שיכיל את האלקטרו-מגנט שבניתם, מתג וסוללות. את קצות הסליל חברו לשני מהדקי תנין.
א. הניחו את קצהו של האלקטרו-מגנט בצלוחית שבה מסמרים קטנים, וסגרו את המעגל החשמלי.
ב. הרימו את האלקטרו-מגנט. במה אתם מבחינים?
ג. פתחו את המעגל החשמלי. מה קרה למסמרים?
*53*
שתי הפעולות שעשיתם מציגות אחד משימושי האלקטרו-מגנט - העברת גופי ברזל ממקום למקום.
ד. איזו פעולה יש לבצע כדי לפרוק את מטען הברזל?
ה. האם אפשר לבצע אותה פעולה בעזרת מגנט רגיל?
ו. מה השונה ומה המשותף בין מגנט רגיל לבין אלקטרו-מגנט?
למדתם, כי יש להרחיק מסביבת המצפן מגנטים וגופים מברזל, בשעה שרוצים להשתמש בו. אך מחט המצפן עצמה נתונה בקופסה הבנויה בחלקה ממתכת. הציעו ניסויים לבדיקת השאלות הבאות:
א. האם המתכת ממנה עשוי קופסת המצפן היא ברזל?
ב. האם כל מתכת משפיעה על מחט מצפן?
(בספר איור, היעזר במנחה)
*54*
- חומרים שונים מוליכים זרם במידה שונה.
- כאשר מחליפים חוט נחושת בחוט כרום ניקל - עוצמת הזרם קטנה.
*54*
שני ילדים עורכים מירוץ אופניים. האחד נוסע על הכביש, והאחר-נוסע על שביל עפר בצד הכביש.
בוודאי לא תסכימו לתחרות כזו. מדוע?
אפשר לומר שהעפר "מפריע" או "מתנגד" לצמיגי האופניים יותר מאשר הכביש. אם נשווה מצב זה למעבר אלקטרונים במוליכים, נוכל לומר: יש חומרים, שמתנגדים למעבר האלקטרונים יותר מאשר חומרים אחרים.
*55*
התנגדות חשמלית היא שמה של תכונה, שיש לחומרים השונים בטבע. ההתנגדות קיימת בכל חומר וחומר, אך בחומרים מסוימים היא גדולה יותר, ובחומרים אחרים היא קטנה יותר.
בעבודה י"ג בדקתם את המוליכות של הנחושת ושל הכרום ניקל. ראיתם כי הנחושת מוליכה זרם טוב יותר מכרום ניקל.
א. מה נכון לומר לגבי ההתנגדות של שניהם? בחרו בתשובה הנכונה.
1. התנגדות הכרום ניקל למעבר אלקטרונים גדולה מזו של הנחושת.
2. התנגדות הנחושת למעבר אלקטרונים גדולה מזו של הכרום ניקל.
מספר האלקטרונים העוברים בכל שנייה במוליך מושפע ממידת ההתנגדות של המוליך.
במוליכים בעלי התנגדות קטנה - מספר האלקטרונים העוברים בכל שנייה גדול יותר, ולכן הזרם בהם יהיה גדול יותר.
במוליכים בעלי ההתנגדות גדולה - מספר האלקטרונים העוברים בכל שנייה קטן יותר, ולכן הזרם בהם יהיה קטן יותר.
ב. באחת הכיתות נערכו ניסויים לבדיקת ההתנגדות של חמישה חומרים שונים. לפניכם טבלה ובה התוצאות שנרשמו בחמישה מעגלים. המעגלים זהים בכל, פרט לחומר שממנו עשוי הסליל הנבדק.
מספר המעגל | החומר שממנו עשוי הסליל | הקריאה באמפרמטר |
1 | נחושת | 0.35 אמפר |
2 | ברזל | 0.15 אמפר |
3 | אלומיניום | 0.25 אמפר |
4 | כסף | 0.40 אמפר |
5 | כרום ניקל | 0.10 אמפר |
*56*
(בספר תמונה, היעזר במנחה)

1. הכינו רשימה מדורגת של חמשת החומרים שנבדקו. בראש הרשימה כתבו את החומר בעל ההתנגדות הגדולה ביותר ובסופה את החומר בעל ההתנגדות הקטנה ביותר. נמקו את תשובתכם.
2. לו חיברנו לכל מעגל נורה במקום אמפרמטר, באיזה מעגל הנורה הייתה מאירה באור החזק ביותר? נמקו.
ג. לעתים נוח להשתמש במושג מוליכות במקום התנגדות.
אנו אומרים, שהמוליכות של החומר טובה כאשר התנגדותו קטנה. וההיפך, המוליכות גרועה אם ההתנגדות של החומר למעבר אלקטרונים היא גדולה. ניתן לתאר את הקשר בין שתי התכונות הללו בעזרת הסכימה הבאה:
(בספר סכימה, היעזר במנחה)
- התנגדות נמוכה - מוליכות גבוהה
- התנגדות בינונית - מוליכות בינונית
- התנגדות גדולה - מוליכות נמוכה

*57*
לאיזה חומר יש התנגדות גדולה יותר למעבר אלקטרונים, למבדד או למוליך? נמקו.
ד. הכינו רשימה מדורגת של חמשת החומרים שנבדקו (ראו טבלה בעמוד 55). בראש הרשימה כתבו את החומר בעל המוליכות הגבוהה ביותר ובסופה את החומר בעל המוליכות הנמוכה ביותר.
מה ההבדל בין דירוג זה לדירוג על פי שאלה מס' 1?
ה. יעקב ודני בנו שני מעגלים חשמליים, השווים בכל מרכיביהם פרט לחומר, שממנו עשוי אחד מהחוטים המוליכים. במעגל א' הראה האמפרמטר זרם קטן יותר מהזרם שבמעגל ב'.
יעקב הסביר את התוצאות בדרך זו: "הנחושת מעבירה זרם בעל עוצמה גדולה מזו, שמעביר הכרום ניקל". דני הסביר כך: "התנגדות הכרום ניקל גדולה מהתנגדות נחושת".
מי צודק? הסבירו את תשובתכם.
ו. לפניכם התוצאות שהתקבלו בעבודה ח' בעמ' 33.
מספר הנורות במעגל | עוצמת האור בנורה |
1 | חזקה |
2 | בינונית |
3 | חלשה |
הסבירו מהי הסיבה לפחיתה בעוצמת האור?
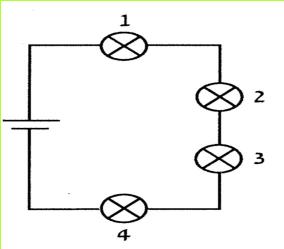
ז. במעגל המתואר בתרשים הבא יש ארבע נורות זהות. עיינו בתרשים ובחרו בתשובה הנכונה. נמקו!
(בספר תרשים, היעזר במנחה)
1. נורה 1 מאירה באור החזק ביותר.
2. נורה 4 מאירה באור החזק ביותר.
3. הנורות 1 ו-4 מאירות, כל אחת, באור חזק יותר מן הנורות 2 ו-3.
4. כל הנורות מאירות באור חזק במידה שווה.
*58*
*58*
כבר למדנו, שעליית הטמפרטורה במעגל החשמלי היא תופעה שכיחה. כאשר עובי המוליכים במעגל החשמלי מתאים לגודל הזרם, עולה הטמפרטורה במעלות בודדות. עלייה זו בטמפרטורה אינה מפריעה, אך כאשר נעשה שימוש לא נכון במכשירים חשמליים, או כתוצאה מתקלה, עליית הטמפרטורה של המוליכים הופכת לבעיה של ממש, ואף לסיכון בטיחותי. כאשר חלה עלייה גדולה מדי בעוצמת הזרם העובר כמוליכים, עולה הטמפרטורה שלהם במעלות רבות. בטמפרטורות גבוהות כאלה המעטה הפלסטי של המוליכים ניתך, ויכול אף להישרף. שרפתו של המעטה הפלסטי יכולה לגרום להתלקחות של חומרים דליקים, שנמצאים בקרבת מקום, ולהתפשטות השרפה.
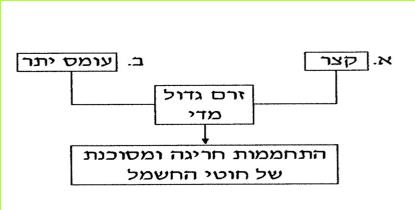
קיימות שתי סיבות עיקריות לעלייה חריגה בטמפרטורה במעגל החשמלי:
א. עלייה בעוצמת הזרם כתוצאה מקצר.
ב. עלייה בעוצמת הזרם כתוצאה מעומס יתר.
(בספר תרשים)
א. קצר - זרם גדול מדי - התחממות חריגה ומסוכנת של חוטי החשמל
ב. עומס יתר - זרם גדול מדי - התחממות חריגה ומסוכנת של חוטי החשמל
מהו קצר חשמלי? על כך נלמד בעבודה הבאה:
א. בנו מעגל בהתאם לתצלום א' שבעמוד הבא.
השתמשו בשני חוטי חיבור, שמהם הוסר קטע קטן מהחומר המבודד. סגרו את המעגל.
1. האם הנורה מאירה?
2. געו בקטעים החשופים. האם אתם חשים בחום?
*59*
(בספר שתי תמונות, היעזר במנחה)

ב. חברו את שני הקטעים החשופים בעזרת מוליך נוסף (ראו תצלום ב').
1. האם הנורה מאירה?
2. האם במעגל שבתצלום ב' עבר זרם חשמלי?
על איזו עובדה התבססתם?
3. הציעו ניסוי ומערכת כלים, שבאמצעותם תוכלו לבחון את תשובתכם לשאלה 2.
ג. נבחן במשותף (דיון כיתתי) חלק מההצעות, שהועלו בקבוצות השונות, ונראה אם אכן הן עונות לשאלה.
הצעה אפשרית אחת היא העבודה שלפניכם.
א. העתיקו למחברת את הטבלה הבאה:
המעגל | האם מופיע אור בנורה? | הקריאה באמפרמטר |
מעגל א' | -- | -- |
מעגל ב' | -- | -- |
*60*
ב. בנו מעגל חשמלי בהתאם לתצלום א'. השלימו את החסר בטבלה ביחס למעגל א'.
(בספר שתי תמונות, היעזר במנחה)
ג. חברו בעזרת מוליך נוסף את שני הקטעים החשופים של החוטים (ראו תצלום ב'). השלימו את החסר בטבלה ביחס למעגל ב'.
כיצד נסביר את העובדה, שאין הנורה מאירה למרות היותה מחוברת למעגל חשמלי סגור? תופעה זו קשורה בהתהוותו של מעגל חדש. המגע בין המוליכים יצר מעגל חשמלי נוסף. כתוצאה מכך חלק גדול מהזרם אינו ממשיך לכיוון הנורה, אלא עובר ישירות להדק החיובי. הזרם המגיע לנורה קטן מאוד, ואין די בו כדי לגרום להתלהטות חוט הלהט.
מדוע מגיע לנורה זרם קטן מאשר למוליכים האחרים במעגל? הסיבה לכך היא ההתנגדות הגדולה של חוט הלהט למעבר הזרם דרכו. למוליכים האחרים במעגל התנגדות קטנה בהרבה, על כן זרם גדול יותר עובר דרכם.
מהו השינוי שנעשה במעגל ושמנע מהזרם לעבור בעוצמה הרגילה דרך חוט הלהט של הנורה?
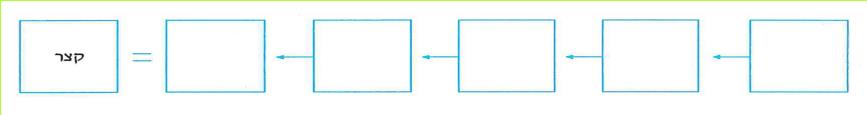
מצב, שבו רוב הזרם החשמלי עובר מהדק אחד להדק אחר של מקור הזרם בלא לעבור דרך מכשיר חשמלי, נקרא קצר.
ד. בעבודה ז' (עמוד 33) נתבקשתם לחבר אמפרמטר למעגל, רק כאשר במעגל מצוי מכשיר חשמלי נוסף. לאור לימודיכם עד כה נסו להסביר, מדוע יש להקפיד על הוראה זו.
*61*
ה. כיצד תסבירו את ההבדל בגודל הזרם, שעבר בשני המעגלים, על פי הרשום בטבלה?
אפשר להגדיר את תופעת הקצר גם על ידי תכונת ההתנגדות של המוליכים במעגל.
ו. עיינו בתצלום הבא והסבירו: מדוע חיבור כזה יגרום לקצר?
(בספר תמונה, היעזר במנחה)
ז. בעמוד 11 בספר זה נתבקשתם להימנע מבניית מעגל חשמלי, שאין בו נורה. הוסבר שם, כי חיבור כזה מקצר את "חיי הסוללה". האם תוכלו להסביר מדוע?
*62*
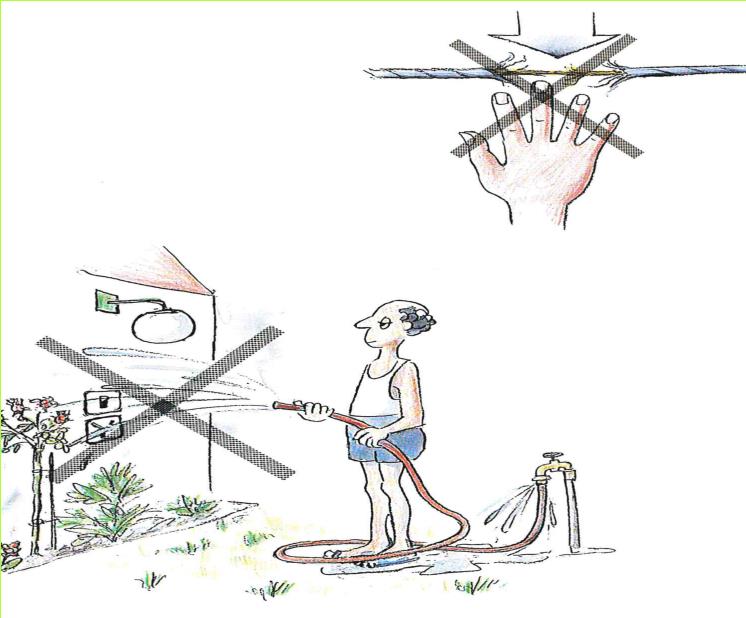
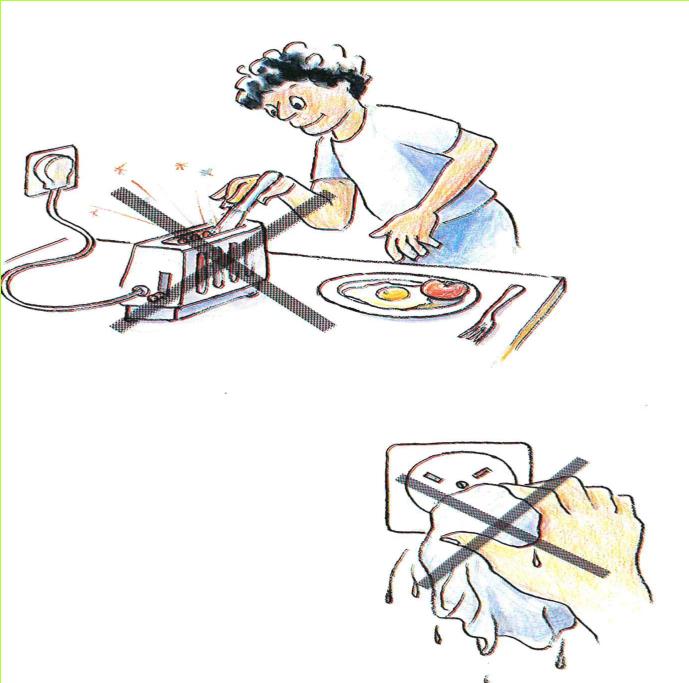
ח. לפניכם איורים המתארים פעולות, שטמונה בהן סכנה רבה. בכל אחת מהפעולות קיים סיכון של התהוות קצר חשמלי, ואף סיכון של התחשמלות. בדרך כלל נעשות פעולות אלה מחוסר ידע, ורק לעתים רחוקות מתוך חוסר זהירות. נסו להסביר, בכל אחד מהמקרים, כיצד הפעולה המסוימת יכולה לגרום להתחשמלות או לקצר חשמלי.
(בספר שתי תמונות, היעזר במנחה)
*63*
(בספר שתי תמונות, היעזר במנחה)
*64*
עד כה למדנו, כי נזקיו של הקצר מתבטאים בהפסקת פעולתם של המכשירים החשמליים, שהיו מחוברים למעגל. ציינו שתי דוגמאות לנזקים העלולים להיגרם בעקבות הפסקת פעולתו של מכשיר חשמלי בגלל קצר.
סכנה חמורה מזו היא סכנת השרפה העלולה לפרוץ בגלל קצר במעגל החשמלי. לפעמים הטמפרטורה הגבוהה של המוליכים בעת הקצר עלולה להצית חומרים דליקים, שנמצאים במגע עם המוליכים, ולגרום בעקבות כך לשרפה.
א. קראו את הקטע הבא, שנלקח מעיתון יומי, והסבירו כיצד גרם הקצר לשרפת הנגרייה.
...נגריית כהן באזור התעשייה של תל אביב עלתה באש ונשרפה כליל. ...מומחי הכבאים והמשטרה קבעו, שהדלקה פרצה כתוצאה מקצר חשמלי... הנזק נמדד בעשרות אלפי ש"ח.
ב. לפניכם רשימה של התרחשויות שיכולות להופיע במעגל החשמלי:
קצר, התחממות רבה של המוליכים, ירידה בהתנגדות, מגע מקרי בין מוליכים חשופים, התכה של אחד המוליכים, הפסקת פעולת המכשיר החשמלי.
שבצו את ההתרחשויות האלה לפי סדר הופעתן במציאות. את תשובתכם כתבו במחברת בצורה הבאה:
(היעזר במנחה)
גורם אחר לעלייה רבה ומסוכנת של טמפרטורת המוליכים, הוא הפעלה בו זמנית של מספר מכשירי חשמל, שלשם פעולתם נדרשת עוצמת זרם גדולה. על מכשירים אלה נמנים: מכונת כביסה, מייבש כביסה, דוד חימום (בויילר), תנור חימום וכו'.
*65*
המעגל החשמלי בבתי המגורים ובמפעלים בנוי בצורה כזו, שתוספת של מכשירי חשמל למעגל אינה מגדילה את ההתנגדות החשמלית במעגל. לכן, כאשר מופעלים בו בזמן מספר מכשירי חשמל כמו: מכונת כביסה, דוד חימום וכר, עובר במוליכים זרם בעל עוצמה גדולה בהרבה מהמותר. לפעמים עוצמת זרם גדולה גורמת לעליית הטמפרטורה של המוליכים עד לרמה של טמפרטורת ההיתוך של החומר, שממנו הם עשויים, ולעתים אף עלולה להיגרם שרפה.
לסיכום תופעת הקצר ותופעת עומס היתר נערוך השוואה ביניהם.
(ריק) | קצר | עומס יתר |
השונה: | א. נגרם מחיבור הדק חיובי להדק שלילי בלי מכשיר חשמלי ביניהם. | א. נגרם על ידי פעולה בו זמנית של מכשירי חשמל, שלשם פעולתם נדרש זרם חשמלי גדול. |
השונה: | ב. קיימת פחיתה פתאומית של ההתנגדות החשמלית במעגל. | ב. ההתנגדות במעגל החשמלי הולכת וקטנה. ככל שמוסיפים מכשירים למעגל. |
השונה: | ג. את הקצר מתקן חשמלאי, המבודד את החוטים שנחשפו ונגעו זה בזה. | ג. הצרכן מנתק מהמעגל את אחד המכשירים, שצורך זרם חשמלי גדול. |
הדומה: | א. במעגל החשמלי עובר זרם גדול מהרגיל. | א. במעגל החשמלי עובר זרם גדול מהרגיל. |
הדומה: | ב. התחממות רבה של המוליכים בגלל עלייה בעוצמת הזרם במעגל. | ב. התחממות רבה של המוליכים בגלל עלייה בעוצמת הזרם במעגל. |
*66*
בעונת החורף, מספר התקלות ברשת החשמל גדול מהרגיל. הדבר נגרם הן בשל רוחות חזקות, הגורמות לקריסת עצים על חוטי חשמל, והן בשל שימוש שיא בו זמני בחשמל בשעות הערב, לצורך חימום הבתים, באזורים רבים בארץ.
לאור מה שלמדתם, באילו מקרים מהמצוינים למעלה נגרמת הפסקת החשמל בשל קצר, ובאילו מקרים היא נגרמת בשל צריכת יתר? נמקו את תשובתכם.
א. בתצלום שלפניכם שתי נורות, רק אחת מהן תאיר, איזו? מדוע?
ב. האם סגירת המעגל שבתצלום תיצור מצב של קצר? נמקו!
(בספר תמונה, היעזר במנחה)
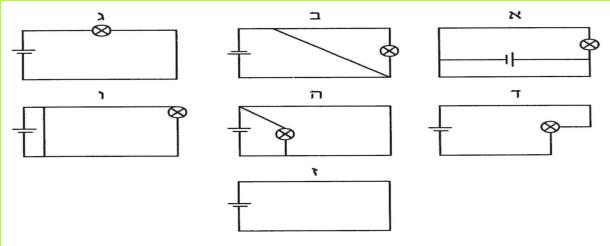
ג. לפניכם מספר מעגלים חשמליים: א-ז. עיינו בהם וציינו, באילו מהם יש מצב של קצר? נמקו את בחירתכם.
(בספר שבעה איורים, היעזר במנחה)
*67*
ד. השם קצר עשוי לפעמים להטעות. יש החושבים, שהוא מלמד על כך שהזרם מקצר את המסלול, שבו הוא עובר - ואין הדבר נכון. ישנם מעגלים חשמליים, שבהם נוצר קצר על אף שהדרך, שהזרם עבר בה, ארוכה מזו שעבר בה לפני הופעת הקצר. תופעת הקצר מתרחשת רק כאשר נוצר מצב, שבו ההתנגדות החשמלית במעגל פוחתת לפתע. בדרך כלל זהו מצב שבו רוב הזרם "עוקף" את המכשיר החשמלי במעגל.
עיינו שוב בשבעת המעגלים שבשאלה ג וציינו: באיזה מעגל המסלול של הזרם התארך, ובכל זאת נוצר מצב של קצר?
- במצב של קצר או עומס יתר עובר במעגל החשמלי זרם בעל עוצמה גדולה מהמותר.
- כאשר עובר זרם בעל עוצמה גדולה מהמותר, עולה הטמפרטורה של המוליכים.
- עליית הטמפרטורה של המוליכים יותר מהמותר עלולה לגרום לנזקים.
*67*
המבטח החשמלי - כשמו כן תפקידו. הוא נועד למנוע נזקים, העלולים להיגרם במצבים של גדילה פתאומית בעוצמת הזרם. נדגיש, כי המבטח החשמלי אינו מסוגל למנוע מצבי קצר. תפקידו לפתוח את המעגל במקרה של קצר או עומס יתר. על אופן פעולתו של המבטח נוכל לעמוד מקרוב בעבודה כ'.
(על נזקי ההתחשמלות ועל דרכי הזהירות שיש לנקוט בעת טיפול באדם, שקיבל מכת חשמל, תוכלו לקרוא בפרק הקריאה - השפעת הזרם החשמלי על נוף האדם, בעמודים 80-81.)
*68*
א. הרכיבו מעגל חשמלי בהתאם לתצלום א'.
ב. סגרו את המעגל בעזרת המתג.
1. התבוננו בחוט הכרום ניקל. במה הבחנתם?
2. התבוננו באמפרמטר. מהי עוצמת הזרם במעגל?
3. האם הנורה מאירה?
(בספר שתי תמונות, היעזר במנחה)
ג. השלימו את הטבלה ביחס למעגל שבתצלום א'.
המעגל | האם הנורה מאירה? | הקריאה באמפרמטר (הזרם במעגל) | האם חוט הכרום ניקל ניתך? |
מעגל א | -- | -- | -- |
מעגל ב | -- | -- | -- |
ד. הוסיפו חוט מקצר למעגל, כפי שמופיע בתצלום ב'.
*69*
ה. סגרו את המעגל.
1. מהי עוצמת הזרם במעגל?
2. מה קרה לחוט הכרום ניקל? הסבירו את הסיבה.
3. האם הנורה ממשיכה להאיר? הסבירו מדוע!
4. השלימו את הטבלה לגבי המעגל שבתצלום ב'.
5. עיינו בטבלה, השוו בין עוצמות הזרם שהיו בשני המעגלים.
מה מצאתם? כיצד תסבירו זאת?
6. לולא נוכחותו של חוט הכרום ניקל במעגל, איזה נזק היה יכול להיגרם לאמפרמטר? (באמפרמטר מצוי סליל העשוי מחוט נחושת דק.)
בדומה למבטח המאולתר בעבודתנו, נבנו מבטחים פשוטים המותקנים כיום במכוניות נוסעים ובמכשירי חשמל שונים. המשותף להם - פתיחת המעגל החשמלי בזמן שעובר דרכו זרם גדול מהמותר.
במבטח החשמלי הפשוט מותקן חוט מתכת דק הניתך בטמפרטורה נמוכה יחסית (כ- 70 מעלות צלזיוס). כאשר עובר במעגל זרם גדול מהמותר - עולה הטמפרטורה במבטח עד לדרגה, שבה ניתך חוט המתכת הדק. בדרך זו נפתח המעגל החשמלי בבית. החוט הדקיק נקרא נתיך, משום שהוא ניתך בטמפרטורה נמוכה מזו של המוליכים האחרים במעגל.
המבטח הפשוט (הנתיך) היה נפוץ בעבר. את מקומו הולך ותופס המבטח החצי אוטומטי. המבטח החצי אוטומטי מותקן בדירות מגורים, בחדרי משרדים, בבתי מלאכה, במפעלי תעשייה, במכונות חשמליות למיניהן ועוד.
*70*
(בספר שלוש תמונות, היעזר במנחה)
- צורות שונות של מבטחים פשוטים

- מבטח חצי אוטומטי

במבטח החצי אוטומטי, פתיחת המעגל (שמתרחשת בו עלייה פתאומית בעוצמת הזרם) נעשית בדרך אחרת. על מנגנון זה תוכלו לקרוא בעמודים 72-73 בקטע "כדאי לדעת: מנגנון הפעולה של מפסק חצי אוטומטי".
(בספר ארבע תמונות, היעזר במנחה)
- מבטח פשוט במצב בו המעגל סגור

- מבטח חצי אוטומטי במצב בו המעגל סגור

- מבטח חצי אוטומטי במצב בו המעגל פתוח

- מבטח פשוט במצב בו המעגל פתוח

*71*
לצורך חידוש הזרם במעגל החשמלי שנפתח על ידי המבטח, יש לסגור את המעגל. סגירת המעגל נעשית על ידי החלפת הנתיך שנפגע בנתיך חדש, או על ידי הרמת מתג הקבוע במבטח החצי אוטומטי. השימוש במבטח החצי אוטומטי קל יותר ואיננו דורש החלפת נתיך.
א. כדי לחדש את זרם החשמל בבית יש לברר תחילה, מה גרם להפסקת החשמל. אין להסתפק בהחלפת הנתיך או בהרמת המתג במבטח החצי אוטומטי. הסבירו מדוע.
ב. ליעקב אזל החוט התקני של הנתיך הפשוט, ובמקומו הכניס חוט הזהה לחוטים המוליכים שבמעגל החשמלי. האם נהג בתבונה? נמקו.
ג. בלוח החשמל המצוי בכל דירה ישנם מספר מפסקים חצי אוטומטיים. בחלקם הם מבטיחים את פעולתם של מעגלים, שבהם עוברת עוצמת זרם קטנה, ובחלקם הם מבטיחים את פעולתם של מעגלים, שבהם עוברת עוצמת זרם גדולה. במה שונות, לדעתכם, שתי קבוצות המבטחים הללו?
ד. האם המבטח החשמלי מונע קצרים? מה תפקידו? הסבירו!
ה. בטבלה בעמוד 65 השווינו בין קצר לעומס יתר. הנתיך מושפע בשני המקרים באופן דומה. כיצד?
*72*
*72*
היום קיימים מפסקים משוכללים יותר מהנתיך הפשוט. הם פותחים אוטומטית את המעגל החשמלי בשעת קצר או עומס יתר. ישנם מפסקים הפועלים בעזרת אלקטרו-מגנט (על אלקטרו-מגנט למדתם בעבודה י"ז בעמוד 52) וישנם מפסקים הפועלים בעזרת דו-מתכת - פסי מתכת המתכופפים בהשפעת חום. שני הפסים צמודים זה לזה לאורכם. פס אחד עשוי מנחושת והשני מאלומיניום. פסי המתכת הם חלק מהמעגל החשמלי. בשעה שעובר בהם זרם בעל עוצמה רבה, הם מתחממים. מאחר שפסי המתכת עשויים מחומרים שונים, השפעת החום עליהם אינה שווה. פס אחד מתארך יותר מהפס השני, וצמד הפסים מקבל צורת קשת. המעגל החשמלי נפתח, ונמנעת הסכנה שיכולה להיגרם מהתלהטות המוליכים.
(בספר שני איורים, היעזר במנחה)
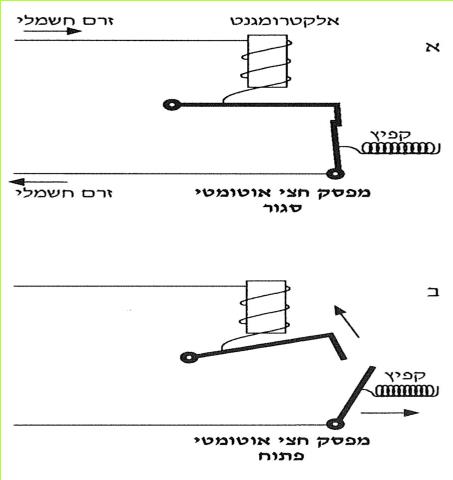
*73*
(בספר שני איורים, היעזר במנחה)
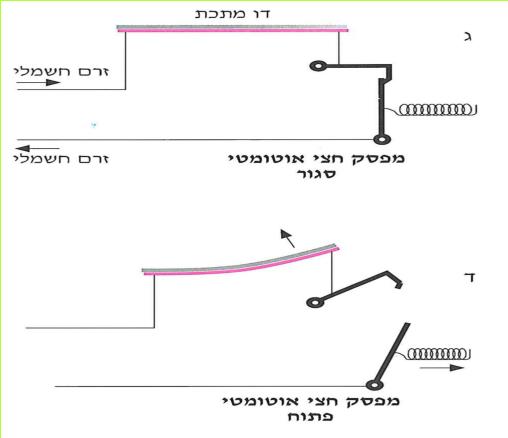
כדאי לזכור, שמכשירים אלה מותקנים כחלק מהמעגל החשמלי הסגור ודרכם עובר זרם חשמלי. אלא שבמצב רגיל פעולתם חלשה, אין בכוחם לפתוח את המעגל, והוא נשאר סגור. רק בזמן שהזרם גדול מדי מתגברת פעולת האלקטרו- מגנט או הדו-מתכת, והמעגל החשמלי נפתח.
*73*
(על נזקי ההתחשמלות ועל דרכי הזהירות שיש לנקוט בעת טיפול באדם, שקיבל מכת חשמל, תוכלו לקרוא בפרק הקריאה - השפעת הזרם החשמלי על נוף האדם, בעמודים 80-81.)
עד עתה למדתם על המבטח החשמלי שנועד למנוע תקלות ונזקים במעגל החשמלי. נוסף לתקלות כמו קצר או עומס יתר, ייתכנו תקלות אחרות שפגיעתן באדם קשה. תקלות כאלה עלולות להיגרם כתוצאה משימוש במכשיר חשמלי פגום.
*74*
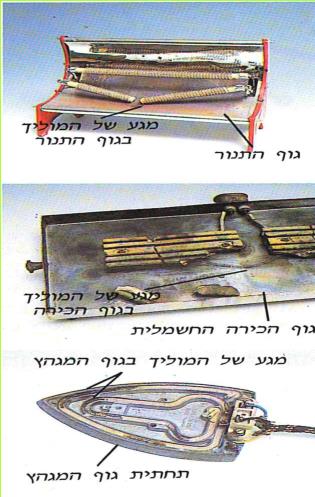
בדרך כלל במכשיר חשמלי תקין אין מגע בין חוטי החשמל שבתוך המכשיר לבין גוף המכשיר. אך קורה לפעמים, שכתוצאה מנפילה של המכשיר או כתוצאה מהתרופפות של אחד מחוטי החשמל שבתוך המכשיר, נוצר מגע בין חוט חשמל לבין גוף המכשיר. מגע כזה נקרא "מגע גוף".
לפניכם מספר תצלומים של מכשירי חשמל שבהם גוף המכשיר החשמלי והחוט המוליך נראים במצב תקין ובמצב פגום.
(בספר שלוש תמונות, היעזר במנחה)

(בספר שלוש תמונות, היעזר במנחה)
*75*
כאשר קיים במכשיר חשמלי "מגע גוף", המכשיר ממשיך לפעול את פעולתו הרגילה, ולא ניכר בו שהוא פגום. אך הנוגע בו עלול לקבל זרם ולהתחשמל. כיצד ניתן להתגונן מפני מכשירים מסוכנים כאלה?
כדי להקטין את סכנת ההתחשמלות ממכשיר שיש בו תקלה של "מגע גוף" אנו מחברים את המכשיר החשמלי לאדמה.
כיצד מתחבר המכשיר החשמלי לאדמה?
(בספר תמונה, היעזר במנחה)

התבוננו בתצלום של המגהץ, שהוסרו ממנו החלקים העליונים.
אנו רואים, כי כבל החשמל המחבר את המגהץ לשקע שבקיר מכיל שלושה חוטי חשמל בצבעים שונים.
החוט החום - מחובר להדק אחד של המגהץ;
החוט הכחול - מחובר להדק השני של המגהץ;
החוט הצהוב-ירוק - מחובר לגוף המגהץ.
הקצה האחר של שלושה חוטים אלה מחובר לשלושה הדקים שבתקע.
כאשר מכניסים את התקע לשקע, שלושת ההדקים שבתקע מתחברים עם שלושה ההדקים שבשקע. שני ההדקים העליונים (1, 2) ממלאים אותו התפקיד, שיש להדקים בסוללה.
(בספר תמונה, היעזר במנחה)
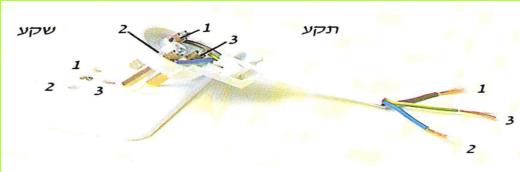
*76*
ואילו ההדק השלישי (3) מחובר לאדמה באמצעות צינור מתכת.
(בספר תמונה, היעזר במנחה)

לפניכם המעגל החשמלי השלם:
(בספר איור, היעזר במנחה)
*77*
עיינו באיור של המעגל החשמלי שבעמוד הקודם וענו על השאלות הבאות:
א. בכבל החשמלי, המופיע באיור, מצויים שלושה חוטי חשמל המסומנים במספרים 3,2,1. באילו מהם יעבור זרם חשמלי כאשר במעגל מחובר מכשיר תקין?
ב. באילו חוטים מבין השלושה (3,2,1) יעבור זרם חשמלי, כאשר במעגל מחובר מכשיר חשמלי שיש בו קלקול מסוג "מגע גוף"? מדוע?
כאשר זרם חשמלי עובר במכשיר, שיש בו פגם מסוג "מגע גוף", חלק מהזרם עובר באמצעות חוט ההארקה לאדמה, אבל חלק אחר של הזרם עלול לעבור דרך גוף האדם שנוגע במכשיר.
לפיכך חשוב לזכור כי מכשיר חשמלי, שיש בו הארקה, אינו מונע את סכנת ההתחשמלות, אלא רק מקטין את נזקיה.
אנו כבר יודעים, כי ההארקה רק מצמצמת את סכנת ההתחשמלות במקרה של נגיעה במכשיר, שיש בו תקלה מסוג "מגע גוף". ההארקה אינה מבטלת את סכנת ההתחשמלות.
כדי להקנות הגנה טובה יותר מפני מכת חשמל העשויה להיגרם בעת שימוש במכשיר חשמלי פגום, או בגלל חוסר זהירות, יש להתקין מתקן מיוחד.
המתקן המאפשר הגנה טובה מפני התחשמלות נקרא:
"ממסר פחת זרם".
*78*
כאשר אדם או בעל חיים אחר נוגעים במוליך לא מבודד, עלול חלק מהזרם החשמלי לעבור דרך גופם אל האדמה. במצב כזה האדם עלול להתחשמל. אם במעגל מותקן מתקן "ממסר פחת זרם" - המתקן פותח את המעגל החשמלי. בכך נמנעת ההתחשמלות של האדם או בעל החיים.
(הניתוק נגרם בעקבות הפחתת עוצמת הזרם, שנבעה מ"בריחת זרם" אל מחוץ למעגל החשמלי. לכן נקרא המכשיר למניעת התחשמלות בשם "ממסר פחת זרם".)
"ממסר פחת זרם" פותח את המעגל החשמלי ברגע, שבו עוצמת הזרם היוצאת ממנו קטנה מעוצמת הזרם הנכנסת אליו. מצב כזה מתרחש, כאשר יש מעבר זרם חשמלי מהמוליכים אל גוף כלשהו מחוץ למעגל החשמלי.
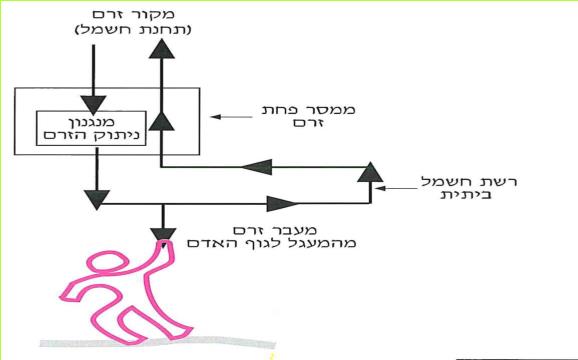
*79*
(בספר תמונה, היעזר במנחה)

- מראה חיצוני של ממסר פחת זרם
פתיחת המעגל על ידי "ממסר פחת זרם" מפסיקה את מעבר הזרם כמוליכים. כך נמנעת הסכנה של קבלת מכת חשמל.
יש הסוברים כי המבטח החשמלי הוא שמקנה הגנה מפני קבלת מכת חשמל ואין הדבר נכון. המבטח החשמלי נועד למנוע נזקים במכשירים חשמליים או סכנת שרפה במבנים ומתקנים שונים. הסיבה לסכנות אלה היא גדילה פתאומית בעוצמת הזרם במעגל.
בכל מבנה שאליו מגיע זרם חשמלי בעוצמה המסוכנת לאדם יש להתקין:
א. "ממסר פחת זרם" למניעת סכנה ממכות חשמל.
ב. מבטח חשמלי למניעת נזקי קצר ועומס יתר.
*80*
*80*
החשמל משמש את האדם בתחומים רבים ומגוונים. אך אליה וקוץ בה; אין רואים את הזרם החשמלי, ולכן קיימת סכנה למשתמשים בו בצורה לא נכונה. שימוש לא זהיר יכול לגרום להעברת זרם דרך הגוף ולקבלת "מכת חשמל". כתוצאה מ"מכת חשמל" עלולים להיגרם לגוף נזקים שונים.
א. נזקים חיצוניים - בנקודה שבה נכנס הזרם ובנקודה שדרכה הוא יוצא, נגרמים פצעי כווייה מפוחמים.
ב. נזקים פנימיים - בעת זרימתו בגוף עלול הזרם לגרום להתכווצויות של שרירים, כמו שריר הלב או השרירים המאפשרים את פעולת הריאות. בדרך זו הוא עלול לגרום לשיבוש הפעילות הסדירה של הלב, להפסקת הנשימה, לאיבוד הכרה ואפילו, במקרים מסוימים, למוות.
מידת הנזק העלול להיגרם לגוף תלויה בין היתר:
א. בעוצמת הזרם החשמלי העובר בגוף האדם - ככל שהעוצמה גדלה, כך גדלים הנזקים לגוף.
ב. במשך הזמן שהזרם עובר בגוף. ככל שמעבר הזרם בגוף האדם מתמשך יותר - גדלים הסיכויים לפגיעה קשה יותר.
למרות העובדה שרוב בני האדם מודעים לסכנות שבהתעסקות בחשמל, לצערנו שכיחות תאונות החשמל. כאשר אדם נקלע למקום שאירעה בו תאונת חשמל, עליו לנקוט את אמצעי הזהירות הבאים:
מאחר שקיימת נטיה להחפז ולהושיט עזרה, יש לזכור שאין לגעת בגוף הנפגע, כל עוד גופו נוגע בגורם המחשמל. זאת משום שבמצב זה גופו של הנפגע מעביר זרם, והנוגע בו יתחשמל בעצמו.
ראשית, יש לנתק את מקור הזרם, ואם אין הדבר ניתן, יש להרחיק את הגורם המחשמל בעזרת עצם העשוי מחומר מבדד. לאחר מכן יש לפעול כלהלן:
א. יש להעביר את הנפגע למקום מאוורר, להשכיבו ולשחררו במהירות מכל דבר העלול להפריע לו לנשימה סדירה.
ב. יש להתחיל מיד בפעולות להחזרת הנשימה ולהמרצת מחזור הדם, באמצעות הנשמה מלאכותית ועיסוי לב.
ג. יש לפנות את הנפגע לבית-חולים, גם אם לא איבד את ההכרה והוא נראה כסובל מפגיעה קלה בלבד. במקרים רבים, שטח הכוויה החיצונית על פני העור קטן יחסית, והדבר עלול להטעות את המטפל. למעשה, נגרם הרס נרחב של רקמות שמתחת לעור, במסלול שבו עבר הזרם.
חשוב לזכור, שניתן להציל חיי אדם שנפגע ממכת חשמל, אך יש לנהוג בקור רוח.
*81*
א. בקטע הקריאה, שקראתם זה עתה, כתוב: החשמל מסוכן מכיוון שאין רואים אותו. הסבירו מדוע קיימת סכנה בכך, שאין רואים אותו.
ב. מדוע חייבים לנתק את הזרם, לפני שמחלצים אדם שנפגע ממכת חשמל?
ג. אילו אמצעי זהירות יש לנקוט, לפני שמשתמשים במכשיר חשמלי? מדוע!
*81*
מיכאל פאראדיי נולד באנגליה לפני כ-200 שנה, בשנת 1791. משפחתו של פאראדיי גרה בכפר. אביו היה נפח עני, שבקושי פירנס את משפחתו. זמן מה אחרי שנולד מיכאל, עברה המשפחה לגור בעיר הבירה לונדון. מיכאל למד בבית ספר בשכונת מגוריו, וכשהיה בן 13 החליט אביו כי הגיע הזמן ללמדו מקצוע, כדי שיוכל לפרנס את עצמו. המקצוע שנבחר היה כריכת ספרים.
בסקרנותו הרבה קרא פאראדיי ספרים רבים מבין אלה שהובאו לכריכייה. הוא התעניין במיוחד במדעי הפיסיקה והכימיה. מאוחר יותר נתקבל לעבוד כשוטף כלים במעבדה לכימיה ופיסיקה של המכון המלכותי של לונדון. במקום זה הוא נתגלה כאדם בעל חוש המצאה נדיר, והמדענים במכון עמדו על כשרונותיו יוצאי הדופן למרות מעמדו הנחות. במרוצת הזמן הפך לפרופסור במכון המלכותי, והשפעת מחקריו על המדע המודרני ידועה עד היום.
בזמנו היה כבר ידוע, כי זרם חשמלי גורם לתופעות מגנטיות, כפי שראינו בעבודה ט"ו (עמ 50) עם המצפן ובעבודה י"ז (עמ' 52) עם האלקטרו-מגנט. פאראדיי שאל את עצמו, אם גם ההיפך הוא אפשרי. האם אפשר להפיק זרם חשמלי על ידי מגנט?
בעבודה י"א למדתם, כיצד ניתן להפיק זרם חשמלי בעזרת מגנט וסליל העשוי ממוליך.
מקור זרם הפועל בעזרת מגנט וסליל נקרא גנרטור (לייצר = to generate). גנרטור קטן, כמו זה המצוי באופניים, נקרא דינאמו (dynamo).

*82*
פאראדיי ערך ניסויים רבים כדי לממש את רעיונו. בתום ניסיונותיו הצליח לבנות את הדינאמו. כאשר גלגל הדינאמו מוצמד לגלגל, והאופניים נמצאים בתנועה, מופק זרם חשמלי ופנס האופניים מאיר.
מהם חלקיו הפנימיים?
לפניכם תצלום של דינאמו הקבוע על האופניים, ותצלום של דינאמו כשהוא מפורק לחלקיו.
(בספר שתי תמונות, היעזר במנחה)


*83*
את חלקיו השונים נערוך בשתי קבוצות:
חלקים חיצוניים וחלקים פנימיים. ניתן לראות, כי חלקיו הפנימיים אינם אלא מיודעינו הסליל והמגנט. תנועת המגנט בתוך הסליל גורמת לתנועת אלקטרונים בכיוון אחד (זרם חשמלי). זרם זה עובר דרך חוט הלהט שבנורה המצויה בפנס האופניים, גורם להתלהטות החוט ולהפצת אור.
כדי להניע את המגנט בתוך הסליל שבדינאמו עלינו לסובב את גלגל השיניים, הקבוע בראש הדינאמו (ראו תצלום).
את סיבוב גלגל השיניים אנו משיגים על ידי הצמדתו לגלגל האופניים והנעת האופניים.
הזרם החשמלי המגיע לבתינו מופק על ידי מכונה גדולה, הנקראת גנרטור. הגנרטור פועל על פי אותו עקרון של הדינאמו. גם בו יש סליל ומגנט, אך הוא מורכב מסלילים וממגנטים רבי עוצמה.
הגנרטור אינו מונע בכוח שרירי הרגליים, כמו הדינאמו באופניים. כאן אנו מנצלים כוחות מלאכותיים כגון קיטור, או תופעות טבע כמו מפלי מים או משבי רוח, ולאחרונה אף אנרגיה גרעינית.
על ניצולם של תופעות טבע כאלו או ניצולם של כוחות מלאכותיים תוכלו לקרוא בקטעי הקריאה שבעמודים הבאים.

א. מהו מקור האלקטרונים המהווים את הזרם החשמלי, העובר דרך פנס האופניים?
ב. מדוע כבה האור בפנס האופניים כאשר האופניים נעצרים?
ג. ודאי שמתם לב, כי כאשר האופניים נמצאים בתנועה מהירה - עוצמת האור יותר גדולה, וכאשר האופניים נמצאים בתנועה איטית - עוצמת האור בפנס קטנה יותר. נסו להסביר מדוע.
ד. האם נכון לומר, שתפקיד הדינאמו באופניים הוא לייצר אלקטרונים עבור המעגל החשמלי באופניים? נמקו את תשובתכם.
*84*
*84*
במשך מאות בשנים השתמשו בזרם המים שבנהרות להנעת גלגלים של טחנות קמח. היום מנצלים את זרמי הנהרות ומפלי המים להפעלת תחנות הידרו-חשמליות (הידרו = מים).
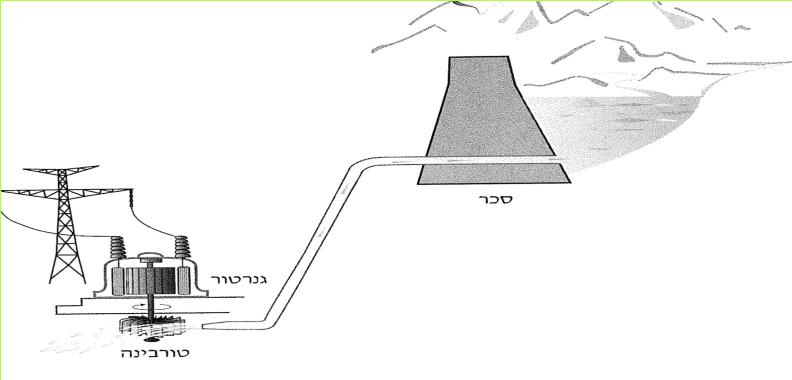
בתחנה ההידרו-חשמלית נמצאים שני מרכיבים חשובים: הגנרטור והטורבינה. ראינו, כי על מנת להפיק חשמל בעזרת דינאמו יש לסובב גלגל, שיסובב את המגנט בתוך הסליל של הדינאמו. גם כדי להפיק חשמל בגנרטור הענק שבתחנת החשמל יש לסובב "גלגל". ה"גלגלי הגדול המצוי בתחנת החשמל נקרא טורבינה. "טורבינה" היא מילה לועזית, שמשמעותה גוף מסתובב.
(בספר איור, היעזר במנחה)
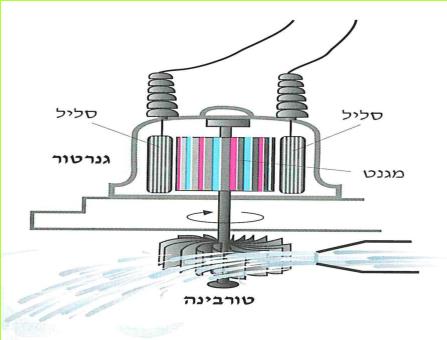
*85*
הטורבינה נראית כגלגל כנפיים ענק, מעין שבשבת גדולה. כאשר המים הזורמים מכים בכנפי הגלגל, הוא מסתובב ומפעיל את הגנרטור. כלומר, הוא מסובב את המגנט בתוך הסליל של הגנרטור, וכך מפיקים חשמל. כדי להגביר את עוצמת הזרם יוצרים מפל מלאכותי באפיק זרימתו של נהר גדול. לצורך זה יש לחסום את דרכו של הנהר בסכר גבוה, והסכר גורם ליצירת אגם מלאכותי. כשנופלים מי האגם מראש הסכר, נוצר מפל מלאכותי.
לרגלי הסכר מקימים את התחנה ההידרו-חשמלית. בתוך התחנה יש, כאמור, טורבינה וגנרטור. המים שבחלקו העליון של הסכר נכנסים לצינורות ונופלים מגובה רב. בנפילתם הם מניעים את הטורבינה, והטורבינה מפעילה את הגנרטור.
(בספר שני איורים, היעזר במנחה)
*86*
בעבר פעלה בארץ תחנה הידרו-חשמלית. בנה והפעיל אותה המהנדס פנחס רוטנברג, הידוע בכינויו "הזקן מנהריים". התחנה הוקמה בנהריים, שמדרום לכנרת, במקום שבו נשפך נהר הירמוך אל הירדן. מימיהם של שני הנהרות נאספו באגם מלאכותי - אגם נהריים - שנחסם באמצעות שני סכרים.
המים נכנסו לצינורות ענק (קוטר כל צינור 3 מטרים) שבקצותיהם העליונים של הסכרים ונפלו על הטורבינות שלמרגלותיהם. הטורבינות, שהונעו על ידי המים הנופלים, הפעילו את הגנרטורים, אשר הפיקו חשמל.
תחנה הידרו חשמלית זו הוקמה בשנת 1928, ועד שנת 1948 סיפקה חשמל לכל החלק הצפוני של ארץ ישראל.
במלחמת השחרור נכבשה התחנה על ידי הלגיון הירדני, ומאז חדלה לפעול. שרידי התחנה נראים עד היום בין הקיבוצים גשר ואשדות יעקב על גבול ישראל-ירדן.

*87*
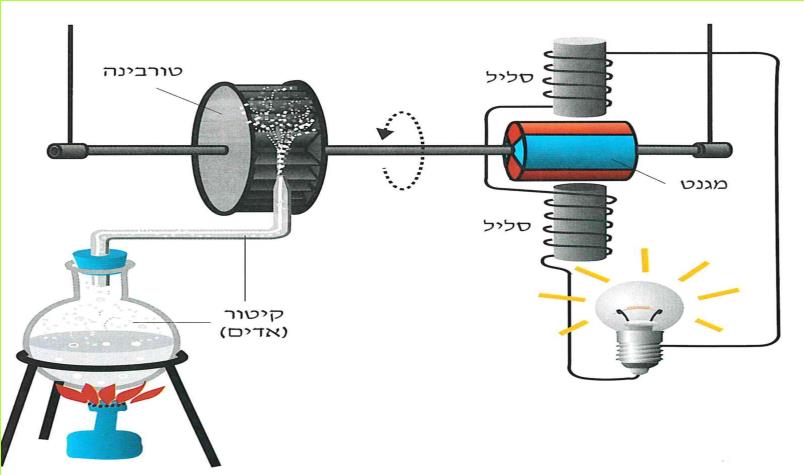
הפקת החשמל נעשית כיום בארץ בתחנות תרמו-חשמליות. אלה הן תחנות שבהן מופעלים הגנרטורים על ידי קיטור. הקיטור הוא אדי מים הנוצרים, כאשר המים רותחים.
את הקיטור יוצרים בתחנות הכוח התרמו-חשמליות על ידי חימום והרתחת המים בתוך דודי ענק. לצורך חימום המים משתמשים בסוגי דלק שונים, כמו: פחם, סולר, מזוט ולאחרונה אף באנרגיה גרעינית.
הקיטור מכוון לעבר הטורבינה ומסובב אותה. הטורבינה מפעילה את הגנרטור. בדרך זו מופק החשמל בתחנה התרמו-חשמלית.
(בספר תרשים, היעזר במנחה)
תרשים של המרכיבים העיקריים בתחנה תרמו-חשמלית.
*88*
(בספר שתי תמונות, היעזר במנחה)
- תחנה תרמו-חשמלית "אשכול" באשדוד


*89*
מאות בשנים נוצלה הרוח להפעלת טחנות קמח ולהשטת ספינות מפרש. כיום אנו עדים לפריחה מחדש של ניצול כוחה של הרוח, והפעם להפקת חשמל.

(בספר תרשים, היעזר במנחה)
- תרשים מבנה טורבינת רוח
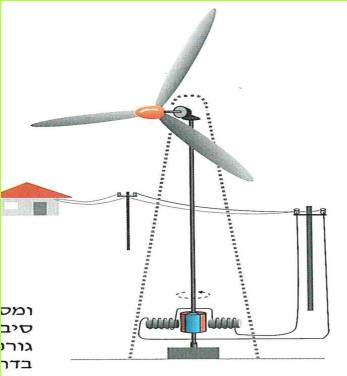
הרוח הנושבת מכה בכנפי הטורבינה ומסובבת אותה. מערכת תמסורת מעבירה את סיבובי הטורבינה לדינאמו ענק. סיבוב הטורבינה גורם לסיבוב של מגנט חזק בתוך סליל של הגנרטור בדרך זו מופק חשמל. כדי לנצל בדרך טובה את הרוח מציבים את הטורבינה על עמוד גבוה, בגובה שבין 60 ל-100 מטר מעל פני האדמה.
*90*
טורבינת הרוח הראשונה בעולם, שתוכננה להפקת חשמל, פעלה בדניה כבר לפני כ-100 שנה, בשנת 1890. עשרים שנה אחר כך פעלו שם כמה מאות טורבינות רוח. גם בארה"ב פעלו טורבינות רוח לאותה המטרה עד שנת 1930, שבה הוזל החשמל לחקלאות.
התייקרות הנפט הגולמי בשווקים הבינלאומיים בשנים שלאחר 1973 הגבירה את ההתעניינות במקורות חלופיים לנפט. גם המודעות הגוברת והולכת לשמירת איכות הסביבה הביאה לבדיקה מחודשת של אפשרות השימוש במשאבי-טבע "נקיים" ככל האפשר (שמש, מים, רוח).
בארה"ב הפך הנושא ליעד לאומי. בספטמבר 1980 חתם נשיא ארה"ב על חוק פדראלי הקובע, כי עד 1988 יותקנו בארה"ב טורבינות רוח, שיפיקו חשמל בכמות השקולה לצריכה של כמאה אלף דירות.
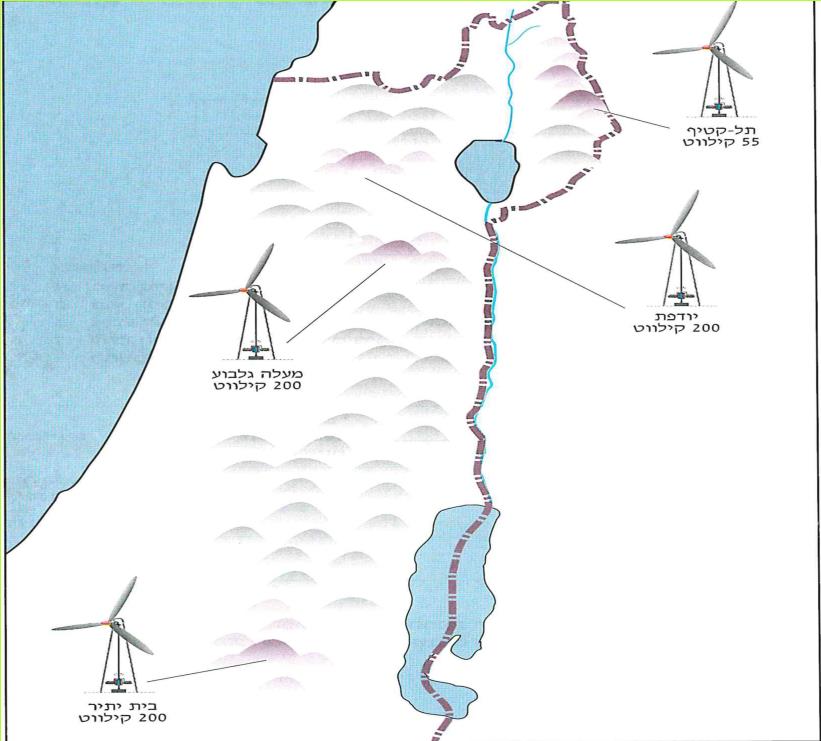
טורבינת הרוח הראשונה בישראל להספקת חשמל לרשת החשמל הארצית הוקמה בשנת 1984, בתל- קטיף שבגולן.
חברת החשמל העמידה טורבינות רוח ברכס יודפת, תל קטיף, ויזמים פרטיים הקימו מתקני ניסוי במעלה הגלבוע, ובבית יתיר. ההצלחה בהם הביאה להיערכות לקראת הקמת "חוות רוח" נוספות.
*91*
מפה ארצית של אתרים עתירי-רוח המיועדים להקמת חוות רוח
(בספר מפה, היעזר במנחה)
*92*
(בספר תרשים זרימה, היעזר במנחה)
- קיטור - (רוח) טורבינה (מים בתנועה) – גנרטור - הופעת זרם חשמלי במעגל
א. מהו תפקידה של הטורבינה?
ב. מהו תפקיד הגנרטור?
ג. מדוע לא ניתן לוותר על הטורבינה ולהסתפק בגנרטור?
ד. ערכו השוואה בין יצירת זרם בפנס אופניים לבין יצירת זרם חשמלי בתחנות החשמל. היעזרו בטבלה הבאה:
המאפיינים | יצירת זרם חשמלי בפנס של אופניים | יצירת זרם חשמלי בתחנת חשמל הידרו-חשמלית | יצירת זרם חשמלי בתחנת חשמל תרמו-חשמלית | יצירת זרם חשמלי בתחנת חשמל טורבינת רוח |
הכוח המסובב את הסליל או את המגנט | -- | -- | -- | -- |
יחידות המבנה העיקריות | -- | -- | -- | -- |
מקור האלקטרונים במעגל הוא ב- | -- | -- | -- | -- |
ה. מהם הדברים המשותפים לכל סוגי תחנות החשמל?
ו. מה המשותף לכל המקומות בארץ, שבהם הוקמו תחנות חשמל המופעלות על ידי הרוח?
ז. עבור מה משלמים ב"חשבון המים"? עבור מה משלמים ב"חשבון החשמל"?
*93*
*93*
קצת מוזר לשמוע את אנשי חברת החשמל מעודדים אותנו לחסוך במוצר, שהם מפיקים עבורנו. הם עושים זאת, מכיוון שהחיסכון בחשמל נעשה לכורח המציאות בעולם בכלל ובישראל בפרט.
חברת החשמל, כחברה ציבורית, רואה את ההיבט הלאומי של הנושא. בישראל, החשמל מופק בחלקו באמצעות דלק נוזלי ובחלקו מדלק מוצק, פחם. סוגי דלק אלה מיובאים מחוץ לארץ, ואוצר המדינה משלם בעדם מטבע חוץ יקר. בשנת 1993 צרכה חברת החשמל לשם ייצור חשמל:
5,758,493 טון דלק מוצק (פחם) להפעלת טורבינות קיטור.
2,149,147 טון דלק נוזלי (מזוט) להפעלת טורבינות קיטור.
108,763 טון דלק נוזלי (סולר) להפעלת טורבינות גז (גזי השרפה של הסולר הם המסובבים את הטורבינה).
הניסיון מראה, שבעזרת פעולות חיסכון קטנות שאינן פוגעות ברמת חיינו, ניתן לחסוך חשמל רב ובכך לחסוך למדינה דלק מיובא. לכן, סיסמתה של חברת החשמל היא: "השתמש בחשמל בתבונה".
אין זה אומר, שאנו צריכים לשבת בחושך או לרעוד מקור בחורף, אלא לנצל את האנרגיה החשמלית ביעילות ולא לבזבז אותה.
נביא לפניכם כמה דוגמאות לעצות, שחברת החשמל נותנת לצרכניה כדי לחסוך בחשמל.
א. שימוש חסכוני בתאורה. יש לקרב את המנורה למקום, שבו אנחנו זקוקים לה. כשאנו יושבים בפינת החדר וקוראים בעיתון, אין צורך להאיר חדר שלם.
*94*
כשאנו יוצאים מהחדר, אל לנו לשכוח לכבות את האור. אין טעם להאיר חדר, שאין יושבים בו.
אם ברצוננו באור חזק יותר - עדיפה נורה אחת של 100W על שתי נורות של 50W כל אחת.
(W = וואט, יחידה למדידת הספק של מכשיר חשמלי. שמה של היחידה נקרא על שם המדען נייימס וואט.)
ב. חיסכון בחימום מים. יש לבקש מחשמלאי מוסמך, שיכוון ל-60 מעלות צלזיוס את ווסת הטמפרטורה של הדוד לחימום מים. בטמפרטורה זו יהיו מים די חמים, וגם נחסוך חשמל רב.
ג. חיסכון בהסקת הדירה בחורף. אין צורך לחמם חדרים, שאין בני הבית שוהים בהם. יש לבדוק, שאין רוח חודרת מבעד לחרכים. רוח זו גורמת לאיבוד חום רב. התנהגות זו נכונה גם לגבי חימום בחשמל או בהסקה מרכזית. אך איננה נכונה, ואף מסוכנת, לגבי חימום באש פתוחה. כאשר מסיקים את הדירה בתנור נפט או גז, יש חשש לפליטה של גזים רעילים. לכן חובה לאוורר את הדירה. החימום באמצעות חשמל אינו מלווה בזיהום אוויר ולכן די באוורור מועט של הדירה.
הטמפרטורה המומלצת בדירה היא בין 18 מעלות צלזיוס לבין 20 מעלות צלזיוס. אין צורך לחמם את הדירה לטמפרטורות גבוהות מאלו. חימום נוסף רק מכביד על בני הבית ומאלץ אותם לפתוח חלונות.
*95*
ד. חיסכון במיזוג האוויר בדירה בימי הקיץ. עלינו לכוון את ווסת הטמפרטורה של המזגן כך שלא יקרר את החדר יותר מהמידה הדרושה. כדי שחום לא יחדור מבחוץ, יש לסגור היטב את החלונות והדלתות.
הסבירו כיצד שימוש נכון בחשמל יכול להביא לחיסכון בדלק.
*95*
א. כאשר עובר זרם חשמלי במוליך מוצק פירושו של דבר, כי בחומר זורמים אלקטרונים.
ב. הזרם החשמלי הוא זרם של אלקטרונים המצויים במוליכים מוצקים.
ג. יש זרמים בעלי עוצמה קטנה - כמו זרם העובר במחשב כיס, ויש זרמים בעלי עוצמה גדולה, כמו זרם העובר כאשר מכשיר חשמלי, כגון מכונת כביסה, מחובר למעגל החשמלי.
ד. יחידת המידה לעוצמת הזרם החשמלי נקראת אמפר.
ה. המכשיר המשמש למדידת עוצמת הזרם החשמלי נקרא מד-זרם, ובלועזית אמפרמטר.
ו. מעבר זרם במוליך מלווה בהתחממות המוליך.
ז. הסוללה והדינאמו אינם מייצרים אלקטרונים. הם רק גורמים לזרימת האלקטרונים המצויים כמוליכים.
ח. המכשירים החשמליים אינם "מבזבזים" אלקטרונים.
ט. שלוש תופעות מלוות את הזרם החשמלי: חום, אור ומגנטיות.
י. מעבר של זרם גדול במוליך דק גורם להתחממות מהירה של המוליך.
יא. החומרים המוצקים המוליכים זרם חשמלי, אינם מוליכים את הזרם במידה שווה. יש חומרים שהם מוליכים טובים יותר, ויש חומרים שהם מוליכים טובים פחות.
יב. מעבר הזרם החשמלי במוליך תלוי, בין היתר, בהתנגדות של המוליך. ככל שההתנגדות גדולה יותר עוצמת הזרם קטנה יותר.
יג. לחוטי חשמל יש התנגדות קטנה, ואילו למכשירים החשמליים כגון: נורה, מגהץ, מאוורר ועוד, יש התנגדות גדולה יותר.
יד. מעבר במוליכים של זרם בעל עוצמה גדולה מהמותר, גורם להתחממות רבה מדי. כאשר הטמפרטורה של המוליך עולה במידה רבה, המוליך יכול להינתך.
*96*
טו. קצר נוצר, כאשר רוב הזרם החשמלי עוקף את המכשיר החשמלי הנמצא במעגל, או כתוצאה מפחיתה פתאומית בהתנגדות החשמלית במעגל. תופעת הקצר מתרחשת, כאשר מוליכים בלתי מבודדים נוגעים זה בזה.
טז. הקצר גורם לגדילה פתאומית בעוצמת הזרם ולהתחממות המוליכים יתר על המידה.
עומס יתר נגרם על ידי פעולה בו זמנית של מכשירי חשמל הצורכים זרם חשמלי גדול.
יז. המבטח החשמלי נועד למנוע התחממות גדולה מדי של המוליכים, על ידי פתיחת המעגל והפסקת הזרם.
יח. מגע של חוט חשמל בלתי מבודד, הנמצא בתוך מכשיר חשמלי בגוף המכשיר, נקרא "מגע גוף".
יט. הארקה היא חיבור של מכשיר חשמלי לאדמה באמצעות חוט החשמל.
כ. הארקה אינה מונעת התחשמלות כתוצאה מתקלה מסוג "מגע גוף", אלא רק מקטינה את הסכנה.
כא. ממסר פחת זרם הוא מכשיר המורכב במעגל חשמלי ונועד להגן על בני אדם מפני מכת חשמל.
כב. ממסר פחת זרם אינו מונע התחשמלות במצב שבו נוגעים בשני הדקי המעגל באותה העת.
*96*
א. העתיקו את המשפטים הבאים והשלימו אותם:
1. זרם חשמלי הוא זרם של --.
2. הזרם נמדד ביחידות של -- והמכשיר המודד את הזרם החשמלי נקרא בעברית -- ובלועזית --.
ב. העתיקו את המשפטים הבאים ומחקו את המיותר.
1. כאשר מחוג האמפרמטר מראה 0.5 אמפר, זרם (עובר/אינו עובר) במעגל.
2. כאשר מחוג האמפרמטר מראה מספר השונה מ-0, הנורה (חייבת להאיר / אינה חייבת להאיר).
3. במעגל חשמלי שבו יש מגע בין הדק הסוללה לתבריג הנורה בלבד, האמפרמטר (מראה / אינו מראה) על מעבר זרם.
*97*
ג. לפניכם איורים של מעגלים חשמליים.
(בספר ארבעה איורים, היעזר במנחה)
1. באיזה מעגל יראה האמפרמטר, שאכן עובר זרם?
2. מדוע לא יראה האמפרמטר, שזרם עובר בשאר המעגלים?
ד. באיור הבא מתוארים שני אמפרמטרים. בחרו את התשובה הנכונה.
(בספר שני איורים, היעזר במנחה)
1. עוצמת הזרם שווה בשני המעגלים.
2. במעגל א עבר זרם גדול מאשר במעגל ב.
3. במעגל ב עבר זרם גדול מאשר במעגל א.
*98*
ה. לפניכם 4 מעגלים חשמליים. המעגלים נבדלים זה מזה בחומר, שממנו עשויים חוטי החיבור.
1. איזה חומר הוא המוליך הטוב ביותר?
2. איזה חומר הוא בעל ההתנגדות הגדולה ביותר? נמקו.
(בספר ארבעה איורים, היעזר במנחה)
ו. דני בנה מעגל חשמלי וחיבר אליו מוליך העשוי מחומר א'. הוא מצא, שעוצמת הזרם במעגל היא 0.5 אמפר. לאחר מכן החליף את המוליך במוליך העשוי מחומר ב' והוא בעל אותו עובי ואורך כמו של מוליך א'. דני מצא, שעוצמת הזרם במעגל השתנתה ל-0.2 אמפר.
1. איזה חומר מוליך טוב יותר?
2. לאיזה חומר התנגדות גדולה יותר?
ז. מה תפקיד הסוללה במעגל החשמלי? בחרו בתשובה הנכונה.
1. לספק אלקטרונים למעגל החשמלי.
2. לייצר אלקטרונים למעגל החשמלי.
3. לגרום לאלקטרונים לנוע במעגל בכיוון אחד.
4. לחבר את האלקטרונים למעגל החשמלי.
*99*
ח. בחרו את התשובה הנכונה. אמפרמטר עדיף על נורה חשמלית כמכשיר למדידת עוצמת הזרם,
1. כי אור הנורה מפריע למדידה מדויקת.
2. כי האמפרמטר מראה את עוצמת הזרם העוברת במעגל.
3. כי הנורה מתחממת, כשעובר בה זרם חשמלי.
4. כי חוט הלהט עשוי להאיר בעוצמות שונות.
ט. במעגל הבא הנורה אינה מאירה, אף שכל המכשירים תקינים והחוטים מוליכים. מדוע אין הנורה מאירה?
(בספר איור, היעזר במנחה)
1. הזרם חלש מדי.
2. הזרם מגיע רק לחוטים.
3. הזרם מגיע רק לאמפרמטר.
4. הזרם חזק מדי.
י. לאחיו הקטן של יוסי יש רכבת חשמלית. מנוע הרכבת מחובר לסוללה בעזרת מוליכים מנחושת. האח הקטן רצה, שהרכבת תיסע מהר יותר. יוסי החליף את חוטי הנחושת בחוטי כרום-ניקל, שלהם התנגדות גדולה יותר.
מה קרה? הסבר מדוע.
*100*
יא. המעגל המתואר בציור כולל פעמון, נורה וסוללה.
הפעמון מצלצל בקול חלש. כאשר מוציאים את הנורה מן המעגל ומחברים יחד את החוטים - מצלצל הפעמון בקול חזק יותר.
(בספר איור, היעזר במנחה)
בחרו בתשובה הנכונה.
1. על ידי הוצאת הנורה גדל הזרם במעגל.
2. על ידי הוצאת הנורה קטן הזרם במעגל.
3. על ידי הוצאת הנורה גדלה ההתנגדות במעגל.
יב. אדם עמד על שולחן עץ ועסק בהחלפת נורה בביתו. בגלל חוסר תשומת לב נגעו אצבעותיו בשני הדקי בית הנורה, וכתוצאה מכך הוא התחשמל ונפגע אנושות. מפסק פחת זרם שהיה תקין לא מנע את הפגיעה, ואף עמידתו של האיש על שולחן עץ לא סייעה לו.
הסבירו מדוע.
*101*
פרק ב: טעינה חשמלית ומטען חשמלי
אנו כבר יודעים כי:
- הסוללה אינה מייצרת אלקטרונים.
- האלקטרונים, הזורמים במוליכים, מקורם במוליכים עצמם.
*101*
אנו יודעים, כי אלקטרונים זורמים בחומרים המוליכים זרם חשמלי. מקורם של האלקטרונים הזורמים הוא בחומר, שממנו עשוי המוליך. אנו יודעים גם, שישנם חומרים, שאינם מוליכים זרם חשמלי. אלה הם המבדדים. נשאלת השאלה: האם אין בחומרים מבודדים אלקטרונים?
ננסה לענות על שאלה זו בעזרת הניסוי הבא.
עבודה כ"א - מעבר אלקטרונים מגוף לגוף
א. החזיקו ביד אחת אחד משני החוטים שבנורית הניאון (ראו תצלום). ביד האחרת קחו סרגל פלסטיק (שכידוע אינו מוליך זרם) וגעו בקצהו של החוט השני שבנורית הניאון. התבוננו בנורית והמשיכו להחליק את החוט על גבי הסרגל.
(בספר תמונה, היעזר במנחה)

1. האם הופיע אור בנורית הניאון?
2. האם התוצאה הייתה צפויה מראש? מדוע?
*102*
ב. שפשפו את סרגל הפלסטיק בעזרת גרב ניילון או מטלית צמר וגעו שוב עם הסרגל בנורית הניאון, כמו שעשיתם בשלב הראשון.
1. האם הפעם הופיע אור בנורית הניאון?
2. האם התוצאה הייתה צפויה מראש? מדוע?
מניסוי זה לומדים, כי גם בחומרים מבודדים יש אלקטרונים. לו חזרנו על ניסוי זה בחומרים מבודדים אחרים היינו מקבלים אותן תוצאות.
על כן נוכל לומר:
האלקטרונים מצויים הן בחומרים מוליכים והן בחומרים שאינם מוליכים.
הדלקת נורית בעזרת סרגל פלסטיק משופשף במטלית צמר או ניילון הייתה תופעה מפתיעה. תופעה זו מעוררת שאלות אחדות.
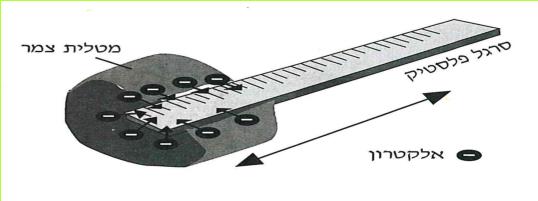
א. מה עשתה פעולת השפשוף לסרגל?
ב. האם סרגל משופשף ממלא אותו תפקיד כשל הסוללה במעגל החשמלי?
נענה על השאלות על פי סדרן:
א. מתברר, שכתוצאה מחיכוך מטלית הצמר בסרגל ומהמשיכה (הזיקה) החזקה של הפלסטיק לאלקטרונים, עברו אלקטרונים ממטלית הצמר לסרגל. לכן פחת מספר האלקטרונים במטלית הצמר, ואילו בסרגל גדל מספרם. בסרגל נתהווה עודף אלקטרונים, ובמטלית הצמר נתהווה מחסור באלקטרונים.
(בספר איור, היעזר במנחה)
*103*
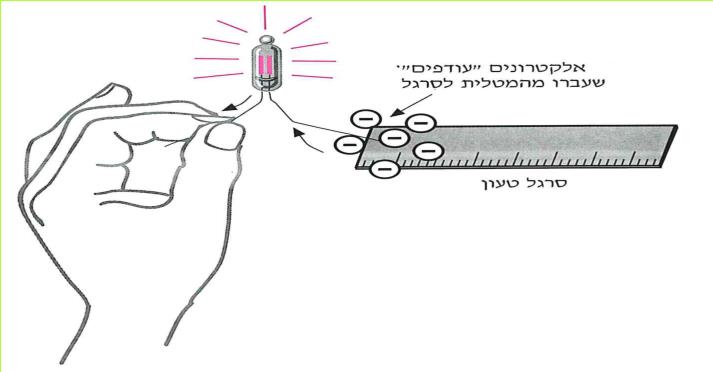
כאשר מחברים את הסרגל לנורית הניאון, האלקטרונים, שנוספו לסרגל עוברים אל הנורית וגורמים לחלק מהאלקטרונים במוליכים שבנורית לזרום. כאשר אלקטרונים זורמים בנורית, הנורית מאירה. כיוון הזרם הוא מהסרגל הטעון אל הנורית, וממנה אל גופנו.
(בספר איור, היעזר במנחה)
ב. הסרגל הטעון ממלא מבחינה מסוימת את התפקיד, שממלאת הסוללה כשמחברים אותה למעגל החשמלי.
כידוע לכם, תפקיד הסוללה לגרום לאלקטרונים שנמצאים במוליכים לזרום בכיוון אחד במעגל, מההדק השלילי להדק החיובי. כך קרה גם עם סרגל הפלסטיק הטעון. במעגל שבו הייתה הנורית, גרם הסרגל לתנועת אלקטרונים בכיוון אחד: מהסרגל אל הנורית וממנה לגופנו.
*104*
ההבדל בין הסוללה לסרגל הטעון מתבטא במשך זמן הפעולה של כל אחד מהם. זמן קצר אחרי חיבור הנורית לסרגל אין היא מאירה עוד, מפני שעודף האלקטרונים שהיה על גבי הסרגל עבר לגופנו. ואילו בנוכחות סוללה במעגל הנורה מאירה במשך שעות רבות.
הופעת אור בנורה אינה התופעה היחידה הנגרמת על ידי סרגל פלסטיק טעון.
נכיר תופעות נוספות.
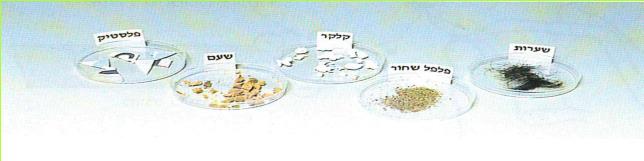
א. טענו סרגל פלסטיק על ידי שפשופו במטלית צמר או ניילון. קרבו את הסרגל אל פיסות החומר המצויות באחת מהצלוחיות שלפניכם.
1. במה הבחנתם?
2. האם התופעה חוזרת על עצמה גם בפיסות החומרים האחרים שבצלוחיות? בדקו זאת.
(בספר תמונה, היעזר במנחה)

ב. האם גם מים מושפעים מקרבתו של סרגל טעון? בדקו שאלה זו בדרך הבאה:
- קחו מיכל פלסטיק קטן שבתחתיתו נקב זעיר.
- סתמו את הנקב באצבע ומלאו את המיכל במים עד למחציתו.
- הרחיקו את האצבע מהנקב והתבוננו בכיוון קילוח המים.
*105*
ג. קרבו אל קילוח המים סרגל לא טעון. האם הבחנתם בשינוי בולט?
עתה קרבו אליו סרגל טעון.
1. האם חל הפעם שינוי בקילוח המים?
2. מה הדמיון בין התופעה שנתגלתה בפיסות החומר השונות, לבין התופעה שנתגלתה בקילוח המים?
מהתוצאות שנתקבלו בעבודה הקודמת ובעבודה זו, אנו רואים, כי השפשוף מקנה לחומר תכונה חדשה, שלא הייתה לו לפני כן. אנו אומרים, כי הגוף המשופשף נטען במטען חשמלי.
בין גוף הטעון במטען חשמלי לבין חומרים שונים קיימת משיכה. היות שהטעינה היא חשמלית, אנו מכנים משיכה זו בשם משיכה חשמלית. יש לציין, שלא כל חומר נמשך לגוף טעון. לדוגמה: שמן, אבקת מתכת ועוד.
בין גוף טעון לבין חומרים מסוימים קיימת משיכה חשמלית.
הרחבה: השפעה אלקטרוסטטית, ראו עמודים 138-140
*105*
נבדוק שאלה זו בעזרת הניסוי הבא.
א. קחו שני פסי פלסטיק, שנגזרו משקף, וקרבו אותם זה לזה.
האם הבחנתם במשיכה או בדחייה בין שני הפסים?
(בספר תמונה, היעזר במנחה)

*106*
ב. הניחו את הפסים זה על גבי זה כשביניהם מטלית צמר או ניילון. החזיקו באחד מקצותיהם ושפשפו אותם בעזרת מטלית הצמר או הניילון (ראו תצלום).
(בספר תמונה, היעזר במנחה)
ג. הרחיקו את המטלית והחזיקו כל פס ביד אחרת. הפנו את הצדדים המשופשפים זה לזה ונסו לקרבם זה אל זה.
במה אתם מרגישים?

(בספר תמונה, היעזר במנחה)

מהתוצאות שנתקבלו מעבודה זו אנו למדים כי:
בחיי היום יום אנו נפגשים בתופעת הטעינה בתחומים רבים ושונים. במרבית המקרים מתרחשת הטעינה שלא במתכוון, אלא כתוצאת לוואי מפעולות שונות. טעינה זו עשויה להסב נזקים לרכוש ואי נעימות לאדם, ואף גרוע מזה.
הרחבה: פרק קריאה - תופעות אלקטרוסטטיות בחיי היום יום, ראו בעמודים 133-136, וזאת לאחר שתסיימו את לימוד פרק ג.
*107*
- על ידי פעולת שפשוף - חיכוך - ניתן לטעון גוף במטען חשמלי.
- בין גוף טעון לבין גופים שאינם טעונים, יכולה להופיע משיכה חשמלית.
- בין גופים טעונים יכולה להתקיים דחייה חשמלית.
*107*
עד כה גרמנו לטעינתם של גופים על ידי שפשופם במטלית צמר. דרך נוספת לטעינה של גופים, היא על ידי חיבורם למקור חשמלי חזק.
(בספר תמונה, היעזר במנחה)
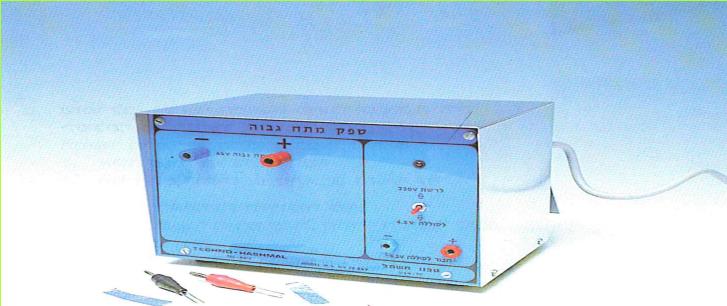
לתשומת לבכם: במוליכים המחוברים למקור החשמלי החזק זורם זרם בעל עוצמה מסוכנת לאדם. שימוש לא נכון במקור החשמלי עלול לגרום לנזק, ועל כן רק המורה רשאי להפעילו.
*108*
(עלי מתכת הם פסים דקים של "נייר כסף".)
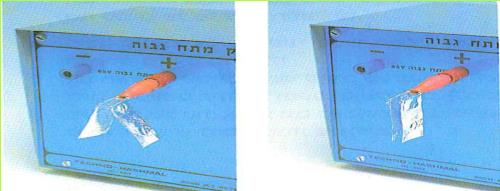
שלב א': חיבור עלי המתכת להדק תשלילי
א. התבוננו בשני עלי המתכת התלויים על המתלה. המקור החשמלי החזק אינו פועל (ראו תצלום).
(בספר תמונה, היעזר במנחה)

1. האם קיימת ביניהם משיכה או דחייה חשמלית?
2. כיצד אתם יודעים זאת?
ב. שימו לב: זוג עלי המתכת מחוברים אל תהדק תשלילי של המקור החשמלי החזק. נפעיל את המקור החשמלי. התבוננו במצב העלים.
(בספר תמונה, היעזר במנחה)

1. איזה שינוי חל בתנוחתם?
2. האם הם דוחים או מושכים זה את זה?
נסכם את העובדות הידועות לנו:
1. כאשר מקור הזרם פועל, ההדק השלילי טעון באלקטרונים.
2. עלי המתכת שחוברו להדק השלילי נטענו באלקטרונים.
3. כתוצאה מהטעינה באלקטרונים דחו עלי המתכת זה את זה.
בין גופים הטעונים באלקטרונים קיימת דחייה חשמלית.
*109*
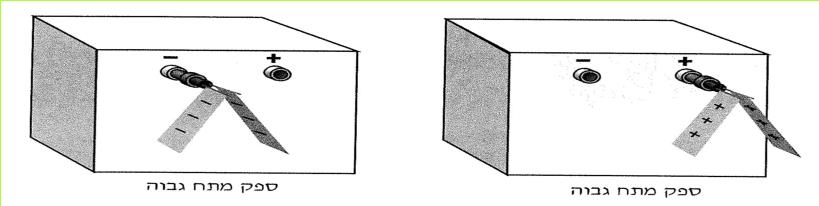
נחבר את עלי המתכת אל ההדק החיובי של המקור החשמלי ונפעיל את המקור.
(בספר תמונה, היעזר במנחה)
האם התנהגותם של עלי המתכת, שחוברו להדק החיובי, דומה לזו של עלי המתכת שחוברו להדק השלילי? אם כן, במה דומה התנהגותם?
התוצאות שקיבלנו בשלב א' ובשלב ב' הן:
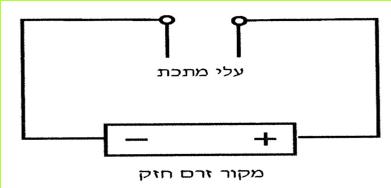
א. נחבר אל ההדק החיובי של המקור החשמלי עלה מתכת אחד, ואל ההדק השלילי עלה מתכת אחר.
ב. נפעיל את המקור החשמלי החזק. מה קרה הפעם לעלי המתכת? האם הם דחו או משכו זה את זה?
עלי מתכת, המחוברים להדקים שונים של מקור חשמלי, מושכים זה את זה.

*110*
ג. כיצד אפשר להסביר את המשיכה החשמלית בין שני עלי המתכת, שהיו מחוברים להדקים השונים של מקור החשמל החזק?
לא נוכל להסביר את המשיכה שבין עלי המתכת על ידי קיומם של אלקטרונים בלבד. שכן, לא מתקבל על הדעת שהאלקטרונים גם ימשכו וגם ידחו זה את זה. לכן משערים, שההסבר לתופעות אלו הוא קיומם של שני סוגים של מטענים חשמליים.
ד. כיצד קיומם של שני סוגי מטען חשמלי מסביר את תופעת המשיכה או הדחייה בין עלי המתכת?
אנו משערים שקיימים שני סוגים של מטענים חשמליים. מטעמי נוחות נקרא להם: מטענים חיוביים ומטענים שליליים. (לביטויים "חיובי" ו"שלילי" אין משמעות של טוב או רע וגם לא משמעות מתימטית של + או -. הכוונה היא למטענים שיש להם תכונות מנוגדות).
את המטענים החיובים נסמן ב +.
את המטענים השליליים נסמן ב - .
ההדק החיובי של המקור טעון במטענים חיוביים, לכן הוא נקרא הדק חיובי. ההדק השלילי של המקור טעון במטענים שליליים, לכן הוא נקרא הדק שלילי. האלקטרונים הם המטענים השליליים.
שני עלי המתכת, שחוברו להדק אחד, נטענו במטען חשמלי של אותו הדק.
כאשר עלי המתכת היו מחוברים להדק החיובי, הם נטענו במטענים חיוביים.
כאשר עלי המתכת היו מחוברים להדק השלילי, הם נטענו במטענים שליליים.
(בספר תמונה, היעזר במנחה)
*111*
לאור תוצאות אלה ניתן לומר:
כאשר עלי המתכת חוברו להדקים שונים (+ ו -), נטענו העלים במטענים חשמליים שונים. העלה שחובר להדק החיובי, נטען במטען חשמלי חיובי. העלה שהיה מחובר להדק השלילי, נטען במטען חשמלי שלילי. במצב כזה הם נמשכים זה לזה.
(בספר תמונה, היעזר במנחה)
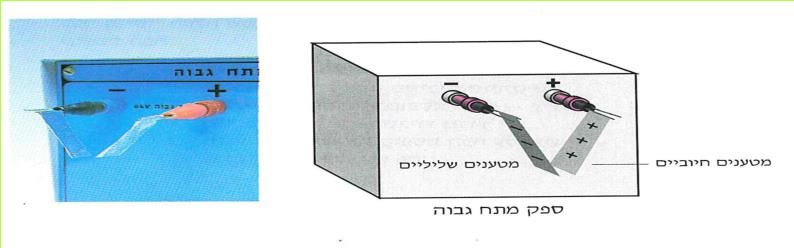
ה. מה יקרה לעלי המתכת הטעונים, כאשר ננתק אותם ממקור הזרם? נמקו.
ו. נבצע את פעולת ניתוק העלים ממקור הזרם. האם תשובתכם התאמתה?
חשבו וענו
א. כאשר מקרבים את אמת היד למסך הטלוויזיה, בשעה שהיא פועלת, מזדקרות השערות שעל האמה. הסבירו מדוע.
*112*
ב. התבוננו באיורים שלפניכם.
(בספר ארבעה איורים, היעזר במנחה)
איזה מהם מתאר נכונה את מצב העלים לאחר חיבור המקור? הסבירו!
ג. בתצלום שלפניכם קופסת פח. סביב פתח הקופסה כרוך חוט מתכת. על החוט תלוי עלה מתכת, שיכול להתנדנד בחופשיות.
לפני הניסוי העלה שמוט כלפי מטה ונוגע בדופן קופסת הפח.
1. כאשר משפשפים סרגל פלסטיק בנייר עיתון או בפיסת בד עשויה מסיבים סינתטיים, ונוגעים עם הסרגל בקופסת הפח - עלה המתכת מתרומם. הסבירו מדוע.
2. מדוע מעמידים את קופסת הפח על מגש פלסטיק ולא על מגש פח?
(בספר תמונה, היעזר במנחה)

העמקה: טעינה ופריקה של גופים על פי התורה האטומית, ראו עמודים 128-132.
*113*
*113*
א. אלקטרונים מצויים בכל חומר וחומר בעולמנו.
ב. הבאת גוף למצב שבו יש לו עודף באלקטרונים או חסר באלקטרונים, נקראת בשם טעינה חשמלית.
ג. טעינה חשמלית יכולה להיעשות בדרכים שונות. הכרנו שתיים:
1. על ידי חיכוך של שני גופים, העשויים מחומרים שונים, זה בזה.
2. על ידי מקור חשמל חזק.
ד. קיימים שני סוגי מטען חשמלי:
1. מטען חשמלי חיובי שסימנו +
2. מטען חשמלי שלילי שסימנו -
ה. גופים הטעונים במטען זהה דוחים זה את זה. גופים הטעונים במטענים שונים מושכים זה את זה.
ו. לגוף הטעון במטענים שליליים יש עודף באלקטרונים (יותר מטענים שליליים מאשר חיוביים).
לגוף הטעון במטענים חיוביים יש חסר באלקטרונים (יותר מטענים חיוביים מאשר שליליים).
ז. עלה מתכת, שמחובר להדק חיובי, נטען במטען חיובי. עלה מתכת, שמחובר להדק שלילי, נטען במטען שלילי.
ח. עלי מתכת טעונים נשארים עם מטענם, גם כאשר מקור הזרם סגור.
*113*
א. משפשפים סרגל פלסטיק במטלית צמר. איזה מהמשפטים הבאים מתאר נכון את המתרחש?
1. הסרגל והמטלית נטענים באותו מטען חשמלי.
2. הסרגל נטען במטען חשמלי מסוים, והמטלית נטענת במטען הפוך.
3. הסרגל נטען במטען חשמלי מסוים, והמטלית נשארת בלתי טעונה.
4. המטלית נטענת במטען חשמלי, והסרגל אינו נטען.
*114*
ב. לפניכם תאור מערכת שבה יש שני עלי מתכת קרובים זה לזה ומקור זרם חזק שאינו מופעל.
מה מתרחש כאשר מפעילים את מקור הזרם?
(בספר תמונה, היעזר במנחה)
1. שני העלים לא זזים, כי המעגל פתוח.
2. שני העלים מושכים זה את זה, כי נטענו מטענים שונים.
3. שני העלים דוחים זה את זה, כי נטענו מטענים שונים.
4. שני העלים דוחים זה את זה, כי נטענו מטענים זהים.
ג. בין שני עלי מתכת המחוברים להדק החיובי של מקור זרם חזק:
1. פועלים כוחות משיכה בלבד.
2. פועלים כוחות דחייה בלבד.
3. לא פועלים כוחות כלל.
4. לפעמים פועלים כוחות דחייה, ולפעמים פועלים כוחות משיכה.
ד. דחייה חשמלית יכולה להתרחש:
1. רק בין גופים הידועים כמוליכי חשמל.
2. בין כל שני גופים הטעונים במטען חשמלי כלשהו.
3. בין כל שני גופים הטעונים במטען חשמלי זהה.
4. בין כל שני גופים הטעונים במטען חשמלי שונה.
*115*
אנו כבר יודעים, כי בכל חומר קיימים מטענים חשמליים. הבחנו בשני סוגים: מטענים חשמליים חיוביים ומטענים חשמליים שליליים. אך היכן הם מצויים בחומר? כדי שנוכל לענות על שאלה זו, עלינו להכיר תחילה את מבנה החומר.
*115*
מספר החומרים הקיימים בעולמנו עולה על מיליון. מספר זה הולך וגדל משנה לשנה, בשל עבודת כימאים השוקדים על יצירת תרכובות חדשות בהתאם לצרכי התעשייה, החקלאות, הרפואה והמחקר המדעי. לו פירקנו את כל החומרים המצויים בטבע היינו מגלים, כי הם מורכבים מ-92 "אבני בניין". ל"אבני בניין" אלה אנו קוראים יסודות.
על השולחן לפניכם יש אוסף חלקי של יסודות. כל יסוד נתון בקופסה שקופה. על הקופסה רשום שמו של היסוד.
(בספר תמונה, היעזר במנחה)
א. התבוננו במבחר היסודות שלפניכם, מיינו אותם לפי מצב צבירתם בטמפרטורת החדר.

*116*
ב. העתיקו את הטבלה למחברת והשלימו אותה.
מצב צבירה בטמפרטורת החדר
מוצק | נוזל | גז |
-- | -- | -- |
מצב הצבירה של יסוד בטמפרטורת החדר הוא מתכונותיו האופייניות. לכל יסוד יש תכונות רבות ומגוונות נוספות.
לפניכם רשימה חלקית של תכונות שלפיהן נוהגים לתאר את היסודות המוצקים.
1. צבע;
2. ברק;
3. מוליכות חשמלית;
4. אפשרות ריקוע.
ליסודות המוליכים חשמל אנו קוראים בשם מתכות , וליסודות שאינם מוליכים חשמל, אנו קוראים בשם אל-מתכות.
ג. התבוננו שנית ביסודות, שהונחו לפניכם, והשלימו את הטבלה.
שם היסוד | צבע | מוליך חשמלאינו מוליך | מתכת או אל-מתכת |
גפרית | -- | אינו מוליך | -- |
חמצן | -- | אינו מוליך | -- |
יוד | -- | אינו מוליך | -- |
נחושת | -- | -- | -- |
אלומיניום | -- | -- | -- |
מגנזיום | -- | -- | -- |
ברזל | -- | -- | -- |
חנקן | -- | -- | -- |
האסטרונאוטים, שהגיעו לירח, הביאו עמם לכדור הארץ אבנים. באבנים אלה נמצאו אותם היסודות, הנמצאים בכדור הארץ.
*117*
המדענים ערכו גם תצפיות בשמש ובכוכבים אחרים והגיעו למסקנה, כי גם השמש והכוכבים בנויים מאותם היסודות, שאנו מכירים על פני כדור הארץ. היסודות שבכדור הארץ אינם מצויים בכמות שווה. יש הנפוצים יותר, יש הנפוצים פחות, ויש גם נדירים, ולכן שמותיהם פחות מוכרים. רק מעטים מבין היסודות מופיעים בטבע כיסודות חופשיים. כל השאר מופיעים כתרכובות.
הרכב ממוצע של קרום כדור הארץ
אלומיניום - 7.85%
ברזל - 4.50%
חמצן - 47.33%
סידן - 10.63%
פחמן - 0.19%
צורן - 27.74%
כל שאר היסודות 1.76%
(בספר איור, היעזר במנחה)

א. עיינו ברשימה של הרכב קרום כדור הארץ, ורשמו את שמות ארבעת היסודות הנפוצים ביותר.
ב. איזה חלק מכלל היסודות בקרום כדור הארץ מהווים ביחד ארבעת היסודות הנפוצים?
*118*
גופנו, גופם של בעלי חיים אחרים וכן כל הצמחים בנויים מיסודות שונים. לפניכם טבלה המראה את חלקם היחסי של היסודות בגופנו.
היסוד | ב-% |
סידן | 2.30 |
ברזל | 0.01 |
נתרן | 0.10 |
חנקן | 2.02 |
חמצן | 64.20 |
זרחן | 1.10 |
אשלגן | 0.10 |
גפרית | 0.10 |
מימן | 9.00 |
מגנזיום | 0.07 |
פחמן | 21.00 |
יוד | 0.00004 |
פלואור | עקבות |
צורן | עקבות |
ארסן | עקבות |
(בספר איור, היעזר במנחה)
ג. מהם ששת היסודות המהווים את עיקר בניינו של הגוף?
לפי הטבלה המציגה את חלקם היחסי של היסודות בגופנו, ניתן לראות כי קיימים יסודות שכמויותיהם בגוף זעירות. למרות כמותם המזערית הם חיוניים לפעילות תקינה של גופנו. לדוגמה, היסוד יוד. חלקו היחסי מכלל היסודות הבונים את גופנו הוא רק 0.00004%, אך בילדים שבגופם הוא חסר, תהליך הגדילה עלול להיות איטי יותר.
*119*
את היסודות הבונים את גופנו אנו מקבלים דרך המזון. על כן יש חשיבות להקפדה על תפריט מגוון של הארוחות, ואין להסתפק במזון חד גוני.
ד. החלב משמש כמזון הבלעדי של התינוקות. מה אפשר ללמוד מעובדה זו לגבי מגוון היסודות שהחלב מכיל? הסבירו את תשובתכם.
כל יסוד בנוי מסוג אחד של אטומים. לדוגמה - פיסת נחושת בנויה רק מאטומים של נחושת, חתיכת זהב בנויה רק מאטומים של זהב. אילו יכולנו לחתוך חתיכת נחושת לחתיכות זעירות ביותר, היינו מגיעים בסופה של חלוקה זו לחלקיקים הקטנים ביותר של הנחושת. חלקיקים אלה נקראים אטומי נחושת.
חתיכת הנחושת בנויה מאטומים רבים של נחושת הקשורים זה לזה (ראו איור).
(בספר איור, היעזר במנחה)
*120*
חתיכת זהב בנויה מאטומים רבים של זהב הקשורים זה לזה.
א. בטבע קיימים 92 יסודות. כמה סוגי אטומים קיימים בטבע? נמקו.
היסודות הם חומרים שלא ניתן לפרקם לחומרים אחרים. הם משמשים לבניינם של התרכובות, אבל הם עצמם אינם מורכבים מחומרים אחרים.
ב. כיצד אפשר להסביר את הופעתם ויצירתם של חומרים כה רבים ושונים ממספר קטן של יסודות (92)?
ג. האם אתם מכירים תופעה דומה מתחום אחר של לימודיכם (רמז - שפה)?
ההשערה כי החומר מורכב מאטומים היא עתיקת יומין ומקורה עוד בתקופת יוון הקדומה. כבר אז טענו, שאם נחלק חומר ונוסיף לחלקו עוד ועוד נגיע לבסוף לחלקיקים סופיים, שאי אפשר לחלקם יותר. זהו גם מקורו של השם אטום. ביוונית פירושו: בלתי ניתן לחלוקה. (א = לא, טומוס = לחלק. אטום = לא ניתן לחלוקה).
את ההשערה ביססו מחקרים שנעשו מתחילת המאה ה-19 ועד ימינו. לאור העובדות הנסיוניות שנתגלו, הייתה ההשערה על קיום האטומים לתורה הנקראת התורה האטומית. תורה זו אומרת:
*121*
- כל החומרים בנויים מיסודות.
- האטום הוא החלק הקטן ביותר של היסוד.
*121*
במהלך לימודנו על מבנה החומר ועל הזרם החשמלי למדנו שתי עובדות מרכזיות על עולם החומר.
1. כל חומר בנוי מאטומים. 2. בכל חומר מצויים מטענים חשמליים.
כיצד מתקשרות שתי עובדות אלו זו לזו? כדי להשיב על כך עלינו להכיר תחילה את המבנה של האטומים. כיצד בנוי האטום? האם כשמו כן הוא, כלומר האם באמת אינו ניתן לחלוקה?
כדי לענות על שאלות אלו יש לראות את האטום על כל חלקיו. וכאן הבעיה. האטום כה זעיר, שפשוט לא ניתן לראות את מבנהו הפנימי אפילו במיקרוסקופ משוכלל ביותר.
אומנם, בשנת 1986 הצליחו לצלם את האטומים של היסוד צורן (סיליקון) בעזרת מיקרוסקופ משוכלל מאוד ובהגדלה של פי 600,000. אם תתבוננו בצילום תראו צמדים של אטומים, אך לא ניתן לראות אם האטום מורכב מחלקים נוספים.
(בספר תמונה, היעזר במנחה)
אטומים של היסוד צורן בהגדלה פי 600,000

בניגוד לסברה של הפילוסופים היוונים כי האטום אינו ניתן לחלוקה, התברר מניסויים שנעשו מאמצע המאה ה-19 ועד לימינו, כי האטום אינו מקשה אחת, אלא הוא מורכב מחלקיקים שונים. העיקריים שבהם נקראים פרוטונים, נייטרונים ואלקטרונים.
הפרוטונים והנייטרונים נמצאים במרכז האטום. הם מהווים את גרעין האטום. הגרעין תופס נפח זעיר ביותר בתוך האטום. בנוסף לגרעין יש באטום אלקטרונים הנמצאים בתנועה מתמדת. הפרוטונים והנייטרונים צמודים ואינם מתרחקים זה מזה.
לפרוטונים יש מטען חשמלי חיובי שנהוג לסמנו בסימן +. הנייטרונים חסרי מטען חשמלי, כלומר הם נייטרליים. לכן גרעין האטום טעון מטען חיובי. בין הגרעין החיובי לבין האלקטרונים השליליים קיימת משיכה חשמלית.
*122*
נוכל לתאר באיור את אטום הפחמן על מרכיביו השונים.
(בספר איור, היעזר במנחה)
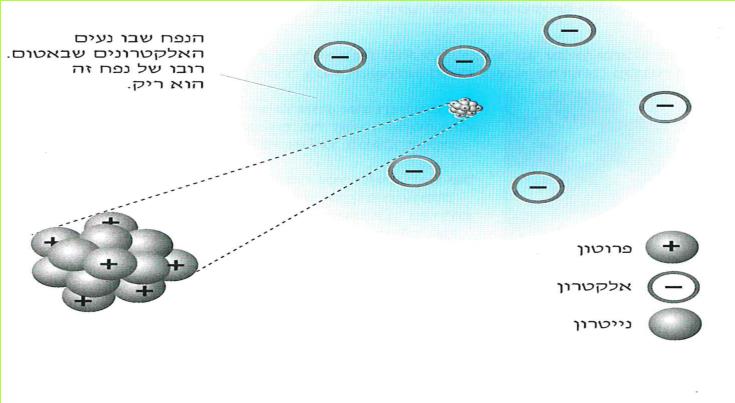
*123*
- כל החומרים בנויים מאטומים.
- האטום מורכב מפרוטונים (+), נייטרונים, ואלקטרונים (-).
*123*
האטום הפשוט ביותר במבנהו הוא אטום המימן. יש בו פרוטון אחד ואלקטרון אחד.
(בספר איור, היעזר במנחה)
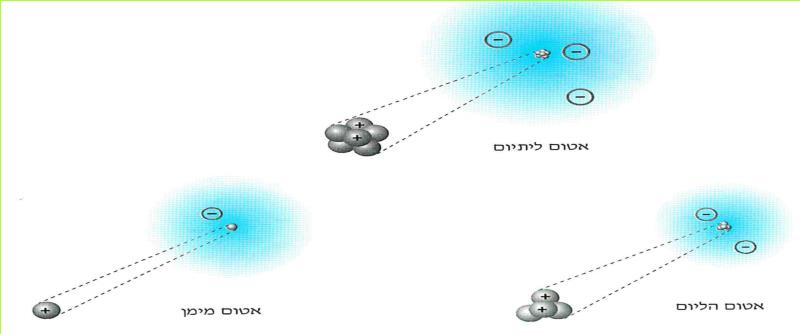
באטום הליום יש שני פרוטונים ושני אלקטרונים.
באטום הליתיום יש שלושה פרוטונים ושלושה אלקטרונים.
שימו לב: בספר זה לא נעסוק במספר הנייטרונים באטום. נוכל רק לומר, כי מספרם שווה למספר הפרוטונים או גדול מהם, מלבד אטום המימן, שבו אין כלל נייטרונים.
א. במה דומה אטום הליתיום לאטום ההליום?
ב. בעמוד הבא תרשימי אטומים של יסודות שונים. התבוננו בהם והשלימו את הטבלה שמתחת לתרשימים (בתרשימים התעלמנו מהנייטרונים).
*124*
(בספר איור, היעזר במנחה)
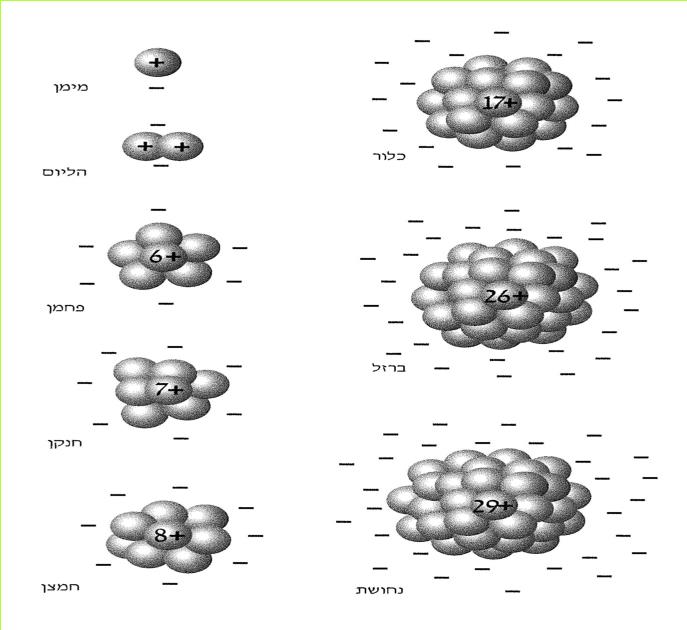
שם האטום | מימן | הליום | חנקן | חמצן | כלור | ברזל | פחמן | נחושת |
מספר פרוטונים | -- | -- | -- | -- | -- | -- | -- | -- |
מספר אלקטרונים | -- | -- | -- | -- | -- | 26 | -- | 29 |
*125*
ג. עיינו בנתונים שרשמתם בטבלה. במה שונים האטומים המתוארים באיורים?
לכל אטומי הנחושת בעולם יש 29 פרוטונים ו-29 אלקטרונים.
לכל אטומי הברזל בעולם יש 26 פרוטונים ו-26 אלקטרונים.
לכל אטומי החמצן בעולם יש 8 פרוטונים ו-8 אלקטרונים.
בכל אטום מספר האלקטרונים שווה למספר הפרוטונים. להלן מספר דוגמאות:
שם היסוד | מספר הפרוטונים | מספר האלקטרונים |
מימן | 1 | 1 |
חנקן | 7 | 7 |
חמצן | 8 | 8 |
כלור | 17 | 17 |
ברזל | 26 | 26 |
כסף | 47 | 47 |
זהב | 79 | 79 |
לאור מה שלמדתם עד כה על מבנה האטום, השלימו במחברתכם את החסר בסעיפים הבאים:
א. בכל האטומים של אותו יסוד יש מספר שווה של ושל --.
ב. אטום של יסוד אחד שונה מאטום של יסוד שני ב- -- וב- --.
קיימים בטבע 92 סוגי שונים של אטומים. חומר יכול להיות בנוי מאטומים שונים או מאטומים מאותו הסוג. היסוד הוא חומר הבנוי מסוג אחד של אטומים. לדוגמה: הברזל הוא יסוד, כי גרגר ברזל או חתיכת ברזל עשויים רק מאטומים של ברזל. מים אינם יסוד, שכן הם בנויים מאטומים שונים, מאטומי מימן ומאטומי חמצן.
א. במה דומים האטומים של אותו יסוד זה לזה?
ב. במה שונים האטומים של יסודות שונים זה מזה?
*126*
- בכל חומר מהווים האלקטרונים חלק ממרכיבי האטום.
- זרם חשמלי במוליך מתכתי הוא זרם של אלקטרונים.
*126*
נוכחנו לדעת, כי אלקטרונים נמצאים בכל החומרים. כמו כן ידוע, כי כל האלקטרונים זהים זה לזה בתכונותיהם. אלקטרון שנמצא באטום של יסוד אחד - זהה בתכונותיו לאלקטרון אחר, שנמצא באטום של יסוד אחר.
לאור עובדות אלו עולה השאלה: מדוע ישנם חומרים, שמאפשרים מעבר זרם חשמלי (מתכות), וישנם חומרים שאינם מעבירים זרם חשמלי (מבדדים)? הסיבה לכך נעוצה במבנה האטום ובמשיכה החשמלית הקיימת בין הפרוטונים לבין האלקטרונים שבאטום.
א. באטומי היסודות המתכתיים מצויים אלקטרון אחד או שניים מכלל האלקטרונים שבאטום, שהמשיכה החשמלית בינם לבין הפרוטונים חלשה מאוד. אלקטרונים אלה ניתקים בקלות מהאטום.
אלקטרונים, הנמשכים אל הפרוטונים שבגרעין בכוחות חלשים מאוד, ניתקים מהאטום בקלות. אלקטרונים אלה נקראים אלקטרונים חופשיים.
האלקטרונים החופשיים אינם ניתקים מגוף המתכת; הם נמצאים בתנועה מתמדת בין האטומים הבונים את המוליך המתכתי. תנועה זו של האלקטרונים החופשיים מתרחשת בכל עת ומושפעת מהטמפרטורה של המוליך. ככל שהטמפרטורה גבוהה יותר - התנועה מהירה יותר.
*127*
התנועה של האלקטרונים החופשיים היא אקראית, כלומר ללא כל כיוון מוגדר ואחיד (ראו איור א'). אולם בשעה שהמוליך המתכתי מחובר למעגל סגור, האלקטרונים החופשיים, שעד כה נעו בצורה אקראית, מקבלים כיוון תנועה אחד. הם זורמים מההדק השלילי של מקור הזרם להדק החיובי. (ראו איור ב').
(בספר איור, היעזר במנחה)

א. תנועת אלקטרונים במוליך שאינו מחובר למעגל חשמלי.
ב. תנועת אלקטרונים במוליך המחובר למעגל חשמלי.
ב. חומרים מבודדים עשויים מיסודות שבאטומיהם אין אלקטרונים חופשיים. כאשר מחברים סוללה למעגל החשמלי, הסוללה גורמת להנעתם של האלקטרונים החופשיים שבאטומים בכיוון אחד. מכיוון שבאטומי היסודות, שמהם בנויים החומרים המבודדים, אין אלקטרונים חופשיים, אין הסוללה יכולה לגרום להנעתם בכיוון אחד.
לאור מה שלמדנו בשיעור זה, נוכל להגדיר את הזרם החשמלי בדרך הבאה:
א. במה שונים אלקטרונים חופשיים משאר האלקטרונים שבאטום?
ב. במה נבדלים חומרים מבודדים מהמתכות?
ג. מהו זרם חשמלי?
ד. מדוע חומרים מבודדים אינם מוליכים זרם חשמלי?
*128*
*128*
במשך לימודנו בנושא "טעינה חשמלית" נוכחנו לדעת, כי גופים יכולים להיטען במטען חשמלי. יש גופים שנטענים במטען חשמלי שלילי, ויש גופים שנטענים במטען חשמלי חיובי.
למדנו, כי בגוף הטעון במטען חשמלי שלילי יש יותר אלקטרונים, משהיו בו לפני טעינתו. כלומר, במהלך פעולת הטעינה נוספו לגוף אלקטרונים.
כיצד נסביר את הטעינה של גוף במטען חשמלי חיובי? כידוע, במהלך פעולת חיכוך או בעת חיבור למקור זרם חזק, האלקטרונים הם שעוברים מגוף לגוף. לעומת זאת, המטענים החיוביים אינם עוברים מגוף לגוף. נסביר את הטעינה החשמלית בדרך הבאה:
גוף שאינו טעון במטען חשמלי, הוא גוף שבו מספר המטענים החיוביים שווה למספר המטענים השליליים. גוף כזה הוא גוף נייטרלי מבחינה חשמלית.
כאשר מחברים עלי מתכת נייטרליים להדק חיובי של מקור הזרם החזק, נלקחים אלקטרונים רבים מהעלים. מספר האלקטרונים בעלים פוחת, בעוד שמספר המטענים החיוביים אינו משתנה. זו הסיבה שהעלה נטען חיובית.
מכאן, שבעת טעינה של גוף במטען חשמלי מדובר כהוספה או כהפחתה של מספר האלקטרונים. מספר המטענים החיוביים אינו משתנה.
נוכל להמחיש כללים אלה בעזרת דגם של עלה נייטרלי ועלה טעון.
כדגם תשמש לנו תבנית ביצים. ה"פסגות" שבתכנית ישמשו לנו מטענים חיוביים. כדורי פינג פונג לבנים ישמשו כאלקטרונים, והתבנית כולה תשמש דגם לעלה מתכת.
התצלום כפי שהוא מוצג כאן מייצג עלה נייטרלי. יש בו 15 מטענים + ו-15 מטענים -.
(בספר איור, היעזר במנחה)

*129*
על ידי הרחקת מספר כדורי פינג פונג (מספר אלקטרונים) ייצג הדגם עלה טעון חיובית. ואילו על ידי הוספת מספר כדורי פינג-פונג ייצג הדגם עלה טעון שלילית. מספר ה"פסגות" בתבנית (מספר המטענים החיוביים) איננו משתנה.
לפניכם שני תצלומים של הדגם שלנו. ציינו איזה מהם מייצג עלה טעון שלילית, ואיזה מהם מייצג עלה טעון חיובית. הסבירו את בחירתכם.
(בספר איור, היעזר במנחה)

א. מה יקרה, לדעתכם, כאשר נחבר באמצעות מוליך שני עלי מתכת, הטעונים במטענים חשמליים שונים? מה הסיבה לכך?
נבדוק את תשובותיכם לסעיף א' לאור הניסוי הבא:
1. נחבר עלה מתכת להדק השלילי ועלה מתכת להדק החיובי, ונפעיל את המקור החשמלי החזק (ראו איור ט').
כיצד הגיבו עלי המתכת?
(בספר איור, היעזר במנחה)
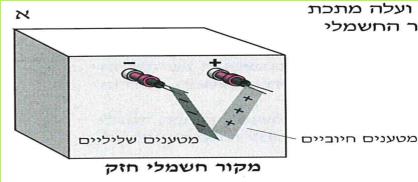
*130*
(בספר שלושה איורים, היעזר במנחה)
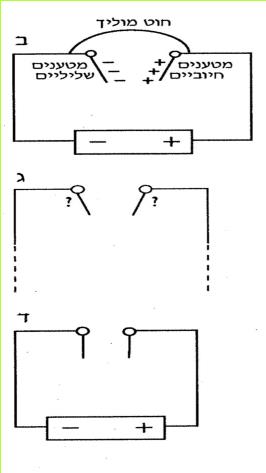
2. נפסיק את פעולת המקור.
א) האם מצב עלי המתכת השתנה?
ב) האם פסקה המשיכה ביניהם?
ג) האם העלים עדיין טעונים?
3. נחבר באמצעות חוט מוליך את שני עלי המתכת. (ראה איור ב').
א) כיצד הגיבו עלי המתכת?
ב) האם קיימת ביניהם משיכה חשמלית?
כיצד אתם יודעים זאת?
ג) האם נכון לומר כי העלים נדחו זה מזה? נמקו.
ג. התבוננו באיור ג'. האם העלים טעונים במטען חשמלי שווה או במטען חשמלי שונה? נמקו.
ד. התבוננו באיור ד'. האם המקור החשמלי החזק פועל או לא פועל? כיצד קבעתם זאת?
כאשר לא קיימת דחייה או משיכה בין גופים, אנו אומרים שהגופים נייטרליים.
הפעולה המביאה להפיכת גוף טעון לגוף נייטרלי נקראת פריקה. הפריקה יכולה להיעשות בשתי דרכים:
א. הוספה של המטענים השליליים החסרים לגוף הטעון חיובית.
ב. הרחקת המטענים השליליים העודפים מהגוף הטעון שלילית.
לאחר הפריקה נעשה הגוף הטעון לגוף נייטרלי, שבו מספר המטענים השליליים שווה למספר המטענים החיוביים.
*131*
(בספר שלושה איורים, היעזר במנחה)
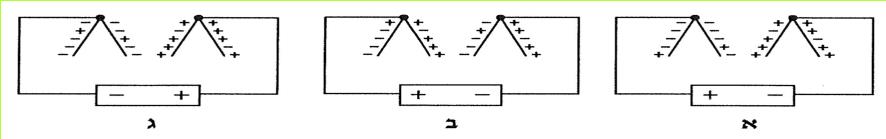
א. באיורים שלפניכם יש מספר מערכות טעינה (א-ג). לכל אחד מתהדקים מחובר זוג עלי מתכת. אילו מהאיורים מתארים נכון את מצב העלים נמקו!
ב. על אף שרק האלקטרונים זורמים, אפשר לקבל גוף, שיש בו עודף של מטענים חיוביים.
היזכרו בניסוי, שבו שפשפנו סרגל פלסטיק במטלית צמר. כזכור, עקב השפשוף נטען הסרגל במטען שלילי, והמטלית נטענה במטען חיובי. כלומר, אלקטרונים עברו מהמטלית לסרגל. הסרגל והמטלית עשויים שניהם מאטומים. עקב השפשוף עברו אלקטרונים מחלק מהאטומים שבונים את המטלית, לחלק מהאטומים שבונים את הסרגל.
הסרגל, שלאטומים שלו נוספו אלקטרונים, נעשה גוף טעון שלילית. ואילו המטלית, שמהאטומים שלה נגרעו אלקטרונים, נעשתה גוף טעון חיובית.
האלקטרונים שנוספים לגוף טעון שלילית, אינם מתקשרים לאטום מסוים דווקא, אלא נמצאים בתנועה, בחלל שבין האטומים שמהם בנוי הגוף. לכן אין אפשרות להצביע על אטום מסוים בגוף הטעון, שזכה בתוספת של אלקטרון.
*132*
(בספר שני איורים, היעזר במנחה)
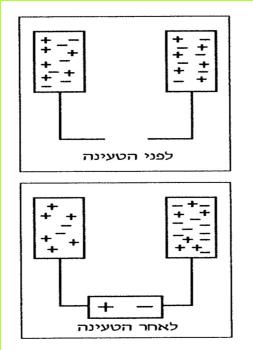
טעינה של עלי מתכת על ידי מקור חשמלי חזק מוסברת כך:
מקור הזרם נוטל חלק מהאלקטרונים שבאטומים הבונים את עלה המתכת, המחובר להדק החיובי, ומעבירם לאטומים הבונים את עלה המתכת המחובר להדק השלילי.
עלה המתכת שמחובר להדק השלילי נטען מטען שלילי.
עלה המתכת שמחובר להדק החיובי, נטען מטען חיובי.
בדרך כלל אין המטען החשמלי נשאר קבוע בגוף, אלא מתפרק ממנו. פעולת הפריקה יכולה להיעשות באחת משתי הדרכים הבאות:
א. גוף הטעון מטען שלילי יכול למסור את האלקטרונים העודפים שבו
1. לאדי המים שבאוויר.
2. לאדמה - אם הגוף מחובר אליה על ידי מוליך, או שהוא נוגע בה.
ב. גוף הטעון במטען חיובי נפרק כאשר עוברים אליו אלקטרונים. האלקטרונים יכולים להגיע אליו מהאוויר או מכל גוף בסביבה. לאחר פעולת הפריקה הופכים הגופים הטעונים לגופים נייטרליים.
יש לזכור כי האלקטרונים אינם נוצרים "יש מאין", כלומר, אינם נוצרים מעצמם, ואינם נעלמים מן העולם.
בעת הטעינה או הפריקה משתנה רק חלוקת כמות האלקטרונים בין הגופים. החלוקה מחדש נעשית על ידי מעבר אלקטרונים מגוף אחד לגוף אחר.
במה שונה פריקה של גוף טעון במטען חיובי מפריקה של גוף הטעון במטען שלילי?
*133*
*133*
(בספר תמונה, היעזר במנחה)

תופעה זו נגרמת על ידי מטענים אלקטרוסטטים. אלה הם מטענים נייחים (סטטיים), הנמצאים על גבי מבדדים או על גבי גופים מוליכים המבודדים מן הסביבה. מה מקורם של מטענים אלה?
בגוף נייטרלי מבחינה חשמלית יש מספר שווה של מטענים חיוביים ומטענים שליליים (אלקטרונים), מטענים חיוביים ושליליים מנטרלים אלה את אלה והגוף הנייטרלי מופיע כלפי חוץ כחסר מטען. ניתן להפר שויון זה בין מטענים ולהפריד מטענים, וכך לטעון גופים.
קיימות מספר דרכים להפרדת מטענים חשמליים. אחת מהן היא מגע וחיכוך בין גופים. במהלך מגע בין גופים מתאימים וחיכוכם זה בזה מתרחש מעבר אלקטרונים מגוף אחד למשנהו. הדבר מתאפשר, כאשר לאחד הגופים יש זיקה (נטייה) רבה יותר לקשור אלקטרונים מאשר לגוף הבא עמו במגע, ולשני זיקה קטנה יותר. שטח המגע של הגוף הקולט אלקטרונים נטען במטענים שליליים. המטענים האלה, הנמצאים על פני שטח הגופים, הם המטענים החשמליים הסטטיים.
*134*
מאז 1945, עם פיתוחם המהיר של חומרים כמו פלסטיק וניילון, רבו המקרים של הצטברות מטענים חשמליים סטטיים, ודבר זה הגביר את העניין בהם ואת המחקר עליהם. התברר, כי התהליך מורכב מזה שתואר פה, אך עיקרו - מעבר של אלקטרונים בעת המגע והישארותם על פני המשטח הקולט, לאחר הפרדת הגופים. תהליך זה הוא גורם ראשון במעלה להופעת חשמל סטטי. מידת הטעינה של הגופים תלויה במספר גורמים:
א. זיקתם של שני הגופים הבאים במגע לאלקטרונים. ככל שההבדל בזיקה בין שני הגופים יהיה גדול יותר, כך תגדל המשיכה ביניהם.
ב. מהירות הניתוק בין הגופים. ככל שההינתקות מהירה יותר, גדל המטען הסטטי המתקבל.
ג. גודל המשטחים הבאים במגע ישיר. ככל שגדול יותר שטח המגע, גדל מספר האלקטרונים העוברים מגוף אחד למשנהו.
ד. המוליכות החשמלית של הגופים - ככל שהמוליכות החשמלית קטנה יותר יצטברו יותר מטענים סטטיים. מבדדים טובים שהתנגדותם החשמלית גדולה, כמו נייר יבש ופלסטיק, שומרים יותר זמן על המטענים הסטטיים. ואילו במוליכי חשמל טובים, כמו מתכות, שהתנגדותם החשמלית קטנה, מתפזרים המטענים במהירות בכל נפח החומר.
כשמקרבים זה לזה שני גופים הטעונים במטענים הפוכים, או כשמקרבים גוף טעון אל האדמה, כך שנוצר רווח קטן מאוד בין שני הגופים בלי שיגעו זה בזה, עלול לעבור ניצוץ חשמלי מגוף אחד למשנהו דרך האוויר, שנמצא ברווח שביניהם. הניצוץ, הפורץ דרך האוויר, עלול לגרום להתפוצצות, אם מצויים באוויר אדי חומר דליק.
מלבד סכנת ההתפוצצות גורם חשמל סטטי לבעיות, שניתן לסווגן ל-4 קבוצות:
1. "מכות חשמל" לאנשים.
2. משיכה והצטברות לכלוך ואבק.
3. הפרעות לתהליכי ייצור תעשייתיים.
4. הפרעות במערכות תקשורת ומחשבים.
אדם עלול לקבל מכת חשמל, כאשר הוא בעצמו נטען במטען סטטי, או כאשר הוא נוגע בגוף טעון בחשמל סטטי. בדרך כלל, מכות חשמל סטטי אינן מהוות סכנה רבה לבריאות, שהרי כמות המטען הסטטי קטנה לרוב, ולפיכך קטן הזרם העובר באדם. עיקר הסכנה הוא בחשש מפני התחושה הלא נעימה של מכת חשמל סטטי, חשש שיכול לגרום לאדם לפעול באופן לא אחראי ולא שקול, תוך הפרת כללי בטיחות בעבודה.
מטענים אלקטרוסטטיים עלולים להפריע בתהליכי הייצור במפעלים לפלסטיק, לחומרי אריזה, לנייר, לטכסטיל, לדפוס ועוד. למשל, מטען סטטי עלול לגרום לגיליונות הנייר במכונת הדפוס להיצמד זה לזה. כתוצאה מכך עלולה המכונה להיתקע, חלק מהגיליונות לא יודפסו, ורבים אחרים ייקרעו ויתקמטו. הבעיה חריפה במיוחד כשמסת החומר עצמו קטנה, למשל בנייר "קרפ" דקיק, עד שדי
*135*
במטען סטטי קטן כדי לגרום להיצמדות גיליונות נייר זה לזה ואל המכונה עצמה. לעתים נוהגים במפעלים אלה להאט בדרך קבע את קצב הייצור כדי להקטין את נזקי החשמל הסטטי; האטה זו, כשלעצמה, כרוכה בנזק כלכלי רב. ניסיונות רבים ליצור צירופי חומרים שאינם יוצרים מטענים אלקטרוסטטיים, עלו עד כה בתוהו. כל שנותר לעשות בשלב זה הוא לבטל מטענים אלקטרוסטטיים לאחר שנוצרו, ובטרם יסכנו, יזיקו או יטרידו.
דרך אחת לכך היא הארקה (חיבור לאדמה) של כל חלקי המתקן, שעלולים להיטען בחשמל סטטי. (אם יוארקו רק חלק מהמרכיבים המוליכים של המתקן, עלולים שאר המרכיבים לצבור חשמל סטטי, שיתפרק תוך פריצת ניצוצות). לדוגמה, מכליות דלק במהלך נסיעתן בימים חמים ויבשים נטענות במטענים חשמליים עקב התחככותן באוויר. המטענים המצטברים עלולים לגרום לניצוץ כתוצאה מהתפרקות אל האדמה של המטען, שהצטבר על גבי המכלית. אם תהיה דליפת דלק, ניצוץ כזה עלול לגרום לשרפה. כדי למנוע סכנה זו ולאפשר הובלה בטוחה של דלקים משתמשים בהארקה. מחברים למכלית שרשרת ברזל, המשתלשלת לכביש ומתחככת בו. המטענים השליליים שהצטברו על גוף המכלית עוברים דרך השרשרת אל האדמה. בדרך זו מורחק המטען החשמלי העודף מהמכלית, והסכנה של התפרקות מטען החשמל באוויר, בליווי ניצוצות, הולכת ופוחתת.
(בספר איור, היעזר במנחה)
שרשרת הארקה
גם מכוניות פרטיות צוברות בנסיעתן בימים חמים ויבשים מטענים סטטיים, ולא פעם קורה, שכאשר נוגעים בהן, חשים במכת חשמל. גם פה, כדי למנוע את מכת
*136*
החשמל מהאדם הנוגע במכונית, מתקינים רצועת גומי, המכילה בתוכה פס מתכת המתחכך בכביש.

דרך אחרת לבטל, או לפחות להקטין, הצטברות של מטענים סטטיים נהוגה בתעשיית הטכסטיל והפלסטיק. היא מבוססת על העלאת כושר ההולכה של החומר. בתעשיות אלה משתמשים בהצלחה מסוימת בחומרי ציפוי. חומרים אלה קולטים לחות מהאוויר, ולחות זו, העוטפת את החומר, מספקת מוליכות חשמלית, שדי בה לפתור את הבעיה.
א. מה הם מטענים אלקטרוסטטיים? מהיכן הם מגיעים לגופים הנטענים?
ב. מה הם הגורמים המשפיעים על מידת הטעינה של גופים שונים?
ג. אילו נזקים עלולים להיגרם על ידי חשמל סטטי?
ד. כיצד מסייעת פעולת ההארקה להקטין, או למנוע, את נזקי החשמל הסטטי?
ה. ביום יבש, גוף המכונית הנוסעת, העשוי מתכת, נטען באלקטרונים רבים. מהיכן הגיעו, לדעתכם, האלקטרונים העודפים לגוף המכונית?
ו. כדי למנוע את אי הנעימות הנגרמת לנוסעים (מכת חשמל קלה) כתוצאה מפריקת המטען החשמלי בעת הנגיעה ברכב, נוהגים חלק מבעלי הרכב להתקין "פס הארקה", המשתלשל מהמכונית לכביש. כיצד "פס ההארקה" פותר את הבעיה?
ז. מדוע מכלית דלק, שחסר בה מתקן הארקה, עלולה להוות מוקד סכנה?
ח. מדוע נוהגים להתקין פס הארקה לכלי הרכב, והרי למכונית יש גלגלים, שממילא נוגעים כל העת באדמה?
ט. מאיזה חומר עשוי פס הארקה? מדוע?
י. האם חשתם פעם מכת חשמל סטטי כתוצאה מנגיעה בידית של מכונית נוסעים (לאחר נסיעה ביום חם ויבש)? אם כן, תארו מה הרגשתם.
*137*
*137*
בניגוד לנורת הליבון אין בנורות ההתפרקות חוט להט. נורות אלו בנויות משפופרת זכוכית מרוקנת מאוויר, או מנורות בעלות "אגס" זכוכית. במקום אוויר הכניסו לתוכן כמות קטנה של גז (ניאון או קריפטון), או כמות קטנה של אדי מתכת (כמו נתרן- או כספית).
(בספר שתי תמונות, היעזר במנחה)

כאשר סוגרים את המעגל החשמלי בתנאים נאותים, המאפשרים מעבר מהיר של אלקטרונים, עוברים האלקטרונים מהדק אחד של השפופרת למשנהו, דרך הגז שבשפופרת. למעבר כזה אנו קוראים התפרקות חשמלית. ראיתם התפרקות דומה בניסוי שבעבודה כ"ז, איור ב' בעמוד 130.
בזמן מעבר האלקטרונים דרך השפופרת הם פוגעים בחלקיקי הגז. כתוצאה מההתנגשויות בין האלקטרונים לבין חלקיקי הגז נפלט אור. צבע האור תלוי בסוג הגז שבשפופרת. כאשר הגז הוא ניאון, נפלט אור אדום. כאשר הגז הוא קריפטון, נפלט אור כחול. שפופרת המכילה אדי כספית פולטת אור לבן. נורות המפיצות אור צבעוני משמשות בעיקר בשלטי פרסומת וכדומה. נורות כספית מאירות דרכים בין עירוניות.
*138*
לתאורה ביתית אנו משתמשים בנורה הפלואורסצנטית. נורה זו שונה מנורות הניאון בכך שהדופן הפנימית של הנורה מצופה בחומר בעל תכונה מיוחדת: כאשר פוגעת בו קרינה, החומר זוהר באור לבן. חומר המפיץ אור כשפוגעת בו קרינה, נקרא חומר פלואורסצנטי, ומכאן שמה של הנורה. מאחר שנורות אלו מתחממות פחות מנורות ליבון, הן הרבה יותר יעילות. הדבר בא לידי ביטוי בצריכה קטנה יותר של חשמל להפקת אותה כמות אור.
(בספר שני איורים, היעזר במנחה)
- 75W - 13W
חיסכון בצריכת החשמל כ-80%
נורת פלואורסצנט קומפקטית נותנת פי 4 עד 5 אור לכל וואט מאשר נורת ליבון רגילה. כתוצאה מכך, נורות הפלואורסצנט חוסכות כ-80 אחוז מצריכת החשמל לתאורה.
8,000 שעות = 1000
*8*
שעות
חייה של נורת פלואורסצנט ארוכים פי 8 עד 10 משל נורת הליבון. קיימות נורות פלואורסצנט דקורטיביות במבחר צורות וניתן להתאימן כמעט לכל מטרה.
נורות הפלואורסצנט פולטות כמות חום מזערית לעומת נורות ליבון או הלוגן - ובאקלים החם שלנו הן מהוות גורם חשוב בהקטנת צריכת החשמל למיזוג אוויר.
*138*
כיצד נוכל להסביר את המשיכה הקיימת בין גוף טעון לגוף נייטרלי, משיכה שעליה למדנו בעבודה כ"בי את המשיכה בין עלה מתכת טעון חיובית לעלה מתכת טעון שלילית הסברנו בקיומם של מטענים שונים, המושכים זה את זה. אך בעבודה כ"ב היה רק גוף אחד טעון. כיצד, אם כן, נמשכו הגופים הנייטרליים לסרגל הטעון?
*139*
לצורך ההסבר נעזר בתרשימים הבאים (א-ג):
כאשר שני גופים נייטרליים קרובים מאוד זה לזה, אין קרבה זו משפיעה על מיקום המטענים שבהם (איור א'). אולם כאשר גוף טעון (כמו באיור ב') נמצא קרוב לגוף נייטרלי, גורם המטען העודף שעל גבי הגוף הטעון לשינוי מקומם של חלק מהמטענים שבגוף הנייטרלי.
(בספר איורים, היעזר במנחה)
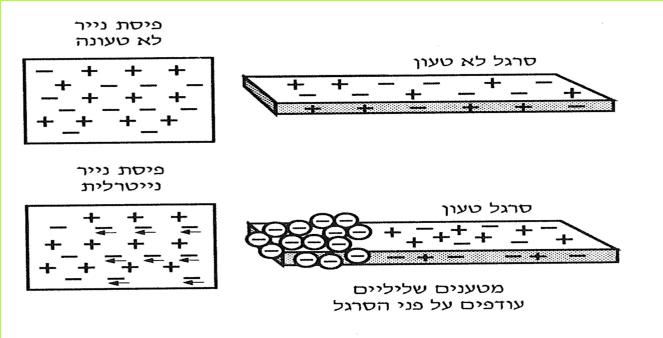
אם לגוף הטעון יש מטען שלילי, יגרום מטען זה לדחייתם של חלק מהמטענים השליליים שבנייר, מהצד הקרוב לקצה הסרגל - אל הצד המרוחק ממנו.
מאחר שהמטענים החיוביים אינם נעים ממקומם, מתהווה על הנייר ריכוז גדול של המטענים החיוביים שבו, בצד הקרוב לקצה הסרגל (איור ג'). בדרך זו הופכת פיסת הנייר מגוף נייטרלי מבחינה חשמלית לגוף, שבו התרחשה הפרדה בין המטענים. כתוצאה מהפרדה זו נוצרו בפיסת הנייר שני אזורים, האחד בעל ריכוז של מטענים חיוביים והאחר בעל ריכוז של מטענים שליליים.
*140*
הסבירו: כיצד הייתה נראית חלוקת המטענים בפיסת נייר, שבסמוך לה היה ניצב גוף טעון חיובית?
כתוצאה מהפרדת המטענים בפיסת הנייר והתהוותם של שני אזורים השונים זה מזה בסוג המטענים, מתהווה משיכה חשמלית בין קצה הסרגל הטעון לבין האזור שבפיסת הנייר, שבו מצויים המטענים החשמליים מהסוג השני.
(בספר איור, היעזר במנחה)
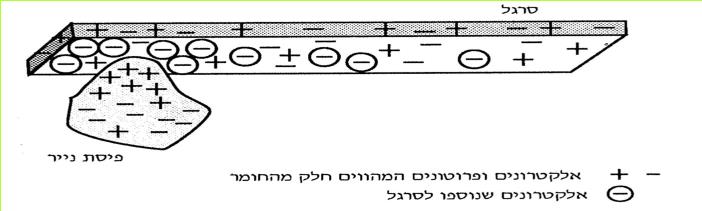
*140*
א. החומרים בנויים מחלקיקים זעירים המכונים אטומים.
ב. יסוד הוא חומר הבנוי מסוג אחד בלבד של אטומים. למשל, הברזל הוא יסוד, כי חתיכת ברזל עשויה רק מאטומים של ברזל.
ג. לכל האטומים של אותו היסוד יש מספר פרוטונים שווה. לאטומים שונים יש מספר פרוטונים שונה.
ד. האטום מורכב מפרוטונים, נייטרונים ואלקטרונים. הפרוטונים והנייטרונים מרוכזים יחד במרכז האטום. אזור זה מכונה גרעין האטום. האלקטרונים נמצאים בתנועה מתמדת.
*141*
ה. לאלקטרון מטען חשמלי שלילי, לפרוטון מטען חשמלי חיובי. הנייטרון חסר מטען חשמלי.
ו. בין הגרעין לבין האלקטרונים הנעים סביבו קיימת משיכה חשמלית. המשיכה מתקיימים בין המטען החיובי של הפרוטונים ובין המטען השלילי של האלקטרונים.
ז. באטומים של יסודות מתכתיים יש אלקטרון אחד או שניים מכלל האלקטרונים שבאטום, שהמשיכה החשמלית בינם לבין הגרעין חלשה. אלקטרונים אלה מכונים אלקטרונים חופשיים.
ח. האלקטרונים החופשיים המצויים במוליכים מתכתיים, הם אלה המהווים את הזרם החשמלי. לכן המתכות מוליכות זרם חשמלי. חומרים מבודדים אינם מוליכים זרם חשמלי, מכיוון שאין להם אלקטרונים חופשים.
ט. סגירת המעגל החשמלי בעזרת מוליך מתכתי מאפשרת זרימת אלקטרונים חופשיים מההדק השלילי להדק החיובי של מקור הזרם.
י. בגוף נייטרלי, מספר המטענים השליליים שווה למספר המטענים החיוביים שבו.
יא. טעינה של גופים מבודדים נעשית כתוצאה מחיכוך בין שני גופים. עקב החיכוך ביניהם עוברים אלקטרונים מחלק מהאטומים של גוף אחד לאטומים של הגוף האחר.
יב. טעינה של גופים מוליכים על ידי מקור זרם חזק היא גריעת אלקטרונים מאטומים של גוף אחד והוספתם לאטומים של גוף אחר.
יג. בעת הטעינה משתנה רק מספר האלקטרונים שבגופים. השינוי נעשה על-ידי מעבר אלקטרונים מגוף אחד למשנהו.
יד. במהלך טעינה חשמלית ובסופה לא חל שינוי במספר המטענים החיוביים. טו. פריקה חשמלית הינה פעולה המביאה להפיכת גוף טעון לגוף נייטרלי מבחינה חשמלית.
*141*
א. התרשים הבא מתאר כיצד בנוי האטום. העתיקו אותו וציינו היכן נמצאים: אלקטרונים, פרוטונים, נייטרונים.
(בספר איור, היעזר במנחה)
ב. כיצד תסבירו את העובדה, שהאטום הוא נייטרלי?
ג. השלימו את המשפטים הבאים:
1. הכוחות הקיימים בין פרוטונים לבין פרוטונים הם כוחות --.
2. הכוחות הקיימים בין אלקטרונים לבין אלקטרונים הם כוחות --.
3. הכוחות הקיימים בין אלקטרונים לבין פרוטונים הם כוחות --.
*142*
ד. יסוד הוא חומר הבנוי:
1. מאטומים מסוגים שונים.
2. מאטומים זהים זה לזה.
3. מאלקטרונים זהים זה לזה.
ה. במה שונים אטומי הנחושת מאטומי גופרית?
1. הפרוטונים שבגרעין הנחושת שונים מהפרוטונים שבגרעין גופרית.
2. באטום הנחושת הפרוטונים והאלקטרונים נמצאים בגרעין, ובאטום גופרית - מחוץ לגרעין.
3. מספר הפרוטונים שבאטום הנחושת שונה ממספר הפרוטונים שבאטום הגופרית.
4. באטום גופרית אין אלקטרונים, ואילו באטום הנחושת יש אלקטרונים.
ו. כתבו על יד כל משפט אם הוא "נכון" או "לא נכון".
1. רק במתכות יש אלקטרונים --.
2. גרעין האטום מכיל את כל הפרוטונים והנייטרונים שבאטום --.
3. בכל סוגי האטומים כל האלקטרונים נמשכים חזק לפרוטונים --.
4. באטומים של יסודות שונים יש מספר שונה של פרוטונים --.
5. לנייטרון אין מטען חשמלי --.
6. לפרוטון יש מטען חשמלי שלילי --.
ז. לפניכם יסוד מתכתי שבו 61 פרוטונים. השלימו את החסר.
1. באטום של יסוד זה יש -- מטענים חיוביים.
2. באטום של יסוד זה במצב נייטרלי -- יש אלקטרונים.
3. באטום של יסוד זה יש/אין אלקטרונים חופשיים (מחקו את המיותר).
4. המשיכה בין גרעין האטום לאלקטרונים החופשיים חזקה/חלשה (מחקו את המיותר).
ח. איזה משפט אינו נכון לגבי אלקטרון חופשי?
1. אלקטרון חופשי אופייני לאטום של מתכת בלבד.
2. אלקטרון חופשי כלל אינו נמשך אל הגרעין.
3. אלקטרון חופשי אינו נמשך בחזקה אל גרעין האטום.
4. אלקטרון חופשי מסוגל לעבור מאטום לאטום.
ט. באילו אטומים ישנם אלקטרונים?
1. רק באטומים של חומרים מוליכים.
2. רק באטומים שיש בהם גם פרוטונים.
3. בכל האטומים.
4. רק באטומים המחוברים למקור זרם.
*143*
י. הפלסטיק הוא חומר מבדד כי:
1. בפלסטיק אין פרוטונים ואין אלקטרונים.
2. באטומים הנמצאים בפלסטיק האלקטרונים חופשיים לנוע מסביב לגרעין, אך לא מאטום לאטום.
3. בפלסטיק מספר האלקטרונים אינו שווה למספר הפרוטונים.
4. בפלסטיק גרעיני האטומים אינם מושכים חזק את כל האלקטרונים.
יא. נחושת מוליכה זרם חשמלי כי:
1. היא בנויה מאטומים, שיש בהם אלקטרונים חופשיים.
2. היא בנויה מאטומים, שיש בהם יותר אלקטרונים מאשר פרוטונים.
3. היא בנויה מאטומים, שבהם כל האלקטרונים יכולים לנוע מאטום לאטום.
4. היא בנויה מאטומים, שבהם גם פרוטונים יכולים לנוע מאטום לאטום.
יב. כאשר מטענו של גוף טעון חיובית מתפרק:
1. עובר עודף האלקטרונים ממנו לגופים, שבהם יש חוסר באלקטרונים.
2. עובר עודף הפרוטונים ממנו לגופים, שבהם יש חוסר בפרוטונים.
3. עוברים אליו האלקטרונים החסרים לו.
4. עוברים אליו הפרוטונים החסרים לו.
יג. איזו מהפעולות הבאות תהפוך זוג עלי מתכת טעונים לעלי מתכת נייטרליים?
(בספר איור, היעזר במנחה)
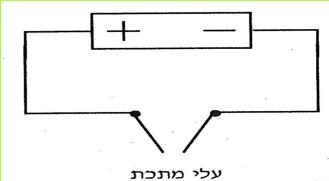
1. ניתוק העלים ממקור הזרם.
2. הצבת מבדד בין העלים.
3. ניתוק שני העלים והרחקתם זה מזה.
4. ניתוק שני העלים ממקור הזרם וחיבורם זה לזה באמצעות מוליך.
3. גוף נייטרלי שנוספו לו מטענים חיוביים.
4, גוף נייטרלי שנגרעו ממנו מטענים חיוביים.
*144*
טו. עיינו באיורים א-ג:
(בספר שלושה איורים, העזר במנחה)
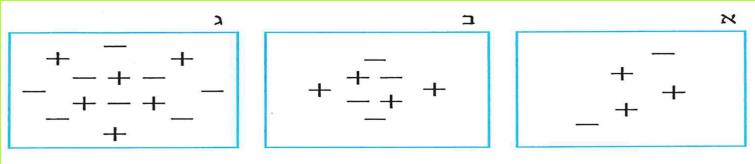
1. איזה תרשים מתאר גוף טעון שלילית?
2. איזה תרשים מתאר גוף טעון חיובית?
3. איזה תרשים מתאר גוף נייטרלי?
טז. כוחות דחייה קיימים:
1. בין מטענים שליליים לבין מטענים חיוביים.
2. בין מטענים שליליים לבין מטענים שליליים.
3. בין מטענים שליליים לבין גוף נייטרלי.
4. בין מטענים חיוביים לבין גוף נייטרלי.
יז. מה מתרחש במהלך פעולת הפריקה החשמלית בשני גופים טעונים (לדוגמה - שני עלי מתכת)?
1. אלקטרונים עוברים מהגוף הטעון שלילית לגוף הטעון חיובית.
2. אלקטרונים עוברים מהגוף הטעון חיובית לגוף הטעון שלילית.
3. פרוטונים עוברים מהגוף הטעון חיובית לגוף הטעון שלילית.
4. פרוטונים עוברים מהגוף הטעון שלילית לגוף הטעון חיובית.
יח. גוף נייטרלי הוא גוף אשר:
1. עשוי מחומר מבודד.
2. אין בו מטענים חיוביים ואין בו מטענים שליליים.
3. אין בו אלקטרונים.
4. יש בו מספר שווה של מטענים חיוביים ומטענים שליליים.
יט. כאשר לגוף נייטרלי נוספים אלקטרונים הוא:
1. נטען במטען חיובי.
2. נטען במטען שלילי.
3. נמשך לגוף טעון שלילי.
4. נדחה על ידי גוף נייטרלי.
*145*
*145*
בפרקים הקודמים למדנו על חומרים מתכתיים, המוליכים זרם חשמלי. זרם חשמלי זורם לא רק במוליכים מתכתיים. הוא עשוי לזרום גם בתמיסות מימיות. תמיסה מימית הינה תערובת של מים עם חומר נוסף. את המים מכנים ממס, והחומר הנוסף המעורב במים מכונה מומס. המומס יכול להיות באחד משלושה מצבי הצבירה של החומר: גז, נוזל או מוצק.
בפרק זה נעסוק בתמיסות, שבהן המומס הוא חומר מוצק בטמפרטורת החדר.
לדוגמה: תמיסה מימית של נחושת כלורית
תמיסה מימית של סוכר
מי ברז
א. ציינו ביחס לשתי התמיסות הראשונות, מהו החומר הממס ומהו החומר המומס.
מי ברז הם תמיסה. זו תערובת של מים וחומרים שונים המצויים בסלעים ובאדמה. המים הם מי גשם, היורדים לאדמה ובדרכם למקום היקוותם הם ממיסים חומרים שונים, המצויים באדמה ובסלעים. בדרך זו נעשים מי הגשם לתמיסה מימית. עדות לנוכחותם של מומסים במי הברז היא האבנית המצויה בקרקעית של קומקום רגיל או קומקום חשמלי.
ב. הציעו ניסוי פשוט, שבעזרתו ניתן לבדוק את כמות המומסים, המצוי ב-1 ליטר מים.
ג. האם לאחר הכנסת חתיכת נחושת למים מתקבלת תמיסה מימית של נחושת? נמקו!
ד. לפניכם צילום תווית של משקה קל מוגז. עיינו בתכולת הבקבוק וכתבו: מהו הממס ומהם המומסים?
(בספר שתי תמונות, היעזר במנחה)

*146*
א. הכניסו שני מוטות פחם לכוס, המכילה מים מזוקקים.
מוטות הפחם מהווים חלק מהמעגל החשמלי ונקראים אלקטרודות.
(בספר תמונה, היעזר במנחה)

ב. הרכיבו את המעגל החשמלי המתואר בתצלום.
ג. סגרו את המעגל.
1. האם עובר זרם חשמלי במעגל? כיצד אתם יודעים זאת?
ד. פתחו את המעגל החשמלי והוציאו את האלקטרודות מהכוס.
הוסיפו כפית שטוחה של נחושת כלורית. בחשו את התערובת של המים והנחושת הכלורית. לאחר שכל אבקת הנחושת הכלורית נמסה במים ומתקבלת תמיסה ירקרקה, הכניסו את זוג האלקטורודות לתמיסה וסגרו את המעגל החשמלי.
2. האם הפעם עבר זרם חשמלי בתמיסה? מהי העדות לכך?
ה. פתחו את המעגל החשמלי והוציאו את האלקטרודות מהכוס!
3. האם מים מזוקקים הם אלקטרוליט? נמקו.
א. הציעו ניסוי מפורט לבדיקת השאלה, אם סוכר הוא אלקטרוליט.
ב. נבחר את ההצעה המתאימה ביותר ונערוך על פיה את הבדיקה. מהי התוצאה? ומהי המסקנה מהניסוי?
ג. האם כל חומר שמתמוסס במים יכול להיקרא אלקטרוליט? נמקו!
*147*
- חומר שתמיסתו המימית מוליכה זרם חשמלי נקרא אלקטרוליט.
- נחושת כלורית היא אלקטרוליט, ואילו מים מזוקקים וסוכר אינם אלקטרוליטים.
- לא כל תמיסה מימית מוליכה זרם חשמלי.
*147*
בדרך כלל, כאשר זרם חשמלי עובר במוליך מתכתי, לא מתרחש שינוי בחומר שממנו עשוי המוליך, פרט אולי להתחממותו. האם כך הוא המצב, בשעה שזרם חשמלי עובר בתמיסה מימית של אלקטרוליטי
כדי לענות על שאלה זו נמשיך ונחקור את המתרחש בתמיסה מימית של נחושת כלורית, בשעה שעובר בה זרם חשמלי.
א. לפניכם כוס כימית ובה תמיסת נחושת כלורית. הכניסו לתמיסה שתי אלקטרודות פחם והרכיבו את המעגל החשמלי כמו בתצלום הבא: האלקטרודה המחוברת להדק השלילי של הסוללה נקראת אלקטרודה שלילית, והאלקטרודה המחוברת להדק החיובי של הסוללה נקראת אלקטרודה חיובית.
(בספר תמונה, היעזר במנחה)
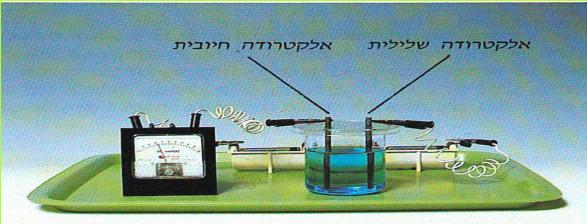
*148*
ב. סגרו את המעגל החשמלי והמתינו כשתי דקות.
1. האם עובר זרם חשמלי במעגל? מהי העדות לכך?
2. התבוננו בתמיסה ליד האלקטרודה החיובית. במה אתם מבחינים?
3. פתחו את המעגל החשמלי, הוציאו את האלקטרודות מהתמיסה. התבוננו באלקטרודה השלילית. מהו השינוי שחל בה?
4. נסו להריח בזהירות את התמיסה, במקום שבו עמדה האלקטרודה החיובית. במה אתם מבחינים?
את פעולת ההרחה עשו בעדינות. זאת מכיוון שישנם חומרים, שאף בריכוז קטן הם עלולים להיות מסוכנים.
ג. העתיקו את הטבלה למחברת והשלימו אותה.
השינויים שהתרחשו כתוצאה ממעבר הזרם בתמיסה | על האלקטרודה החיובית (כן/לא) | על האלקטרודה השלילית (כן/לא) |
הופעת בועות גז | -- | -- |
הופעת ריח חריף | -- | -- |
הופעת ציפוי בעל צבע אדום | -- | -- |
החומר שהתקבל ליד האלקטרודה החיובית הוא הגז כלור. לכלור ריח חריף, המזכיר ריח של אקונומיקה או את הריח המצוי בבריכות שחייה, שנמצאות במבנה סגור.
החומר האדום, שהופיע על גבי האלקטרודה השלילית, הוא נחושת.
לאור התוצאה שהתקבלה בניסוי זה, נוכל לקבוע ולומר, שמעבר של זרם חשמלי בתמיסה מימית של נחושת כלורית גורם לשינויים בחומרים שבתמיסה. לו בדקנו אלקטרוליטים נוספים היינו מוצאים, כי גם בתמיסתם המימית היו מתרחשים שינויים בעקבות מעבר זרם חשמלי בתמיסה. לכן ניתן לסכם ולומר:
מעבר זרם חשמלי בתמיסה מימית של אלקטרוליט גורם לשינויים בחומרים שבתמיסה.
*149*
כדי להבין מי נמשך למעשה אל האלקטרודות, עלינו לדעת, כי בעת שחומר מתמוסס במים הוא נפרד לחלקיקים זעירים, המוקפים בחלקיקי המים. מהעובדה שכל הנחושת התרכזה על אלקטרודה אחת, וכל הכלור התרכז על האלקטרודה האחרת, עולים שני דברים:
א. חלקיקי הנחושת במים נפרדים מחלקיקי הכלור.
ב. אטומי הנחושת ואטומי הכלור אינם נייטרליים (כי רק לחלקיקים טעונים יש משיכה חשמלית). לאטומים אלה יש מטען חשמלי.
בכל קבוצות הניסוי התקבלו אותן תוצאות. על האלקטרודה השלילית הופיעה נחושת, וליד האלקטרודה החיובית הופיעו בועות גז הכלור. נראה שאין זה מקרה, ויש כאן חוקיות מסוימת.
א. מנין הופיעו הכלור והנחושת שהתרכזו ליד האלקטרודות?
ב. מה גרם לכך שכל חומר הופיע תמיד על אלקטרודה מסוימת? נראה שבתמיסת הנחושת הכלורית היו חלקיקים משני סוגים שונים. כל אחד מהם -- אל האלקטרודה האחרת.
מכיוון שמדובר במעגל חשמלי, כנראה הייתה כאן משיכה חשמלית בין החלקיקים שבתמיסה לבין האלקטרודות.
ג. משיכה חשמלית קיימת בין גופים בעלי מטען חשמלי --.
נוכל להניח, שבתמיסה היו חלקיקים חיוביים ושליליים. החלקיקים החיוביים נמשכו לאלקטרודה --, והחלקיקים השליליים נמשכו לאלקטרודה -- לכן:
א. המטען החשמלי של חלקיקי הכלור בתמיסה היה: --.
ב. המטען של חלקיקי הנחושת בתמיסה היה: --.
*150*
- מעבר של זרם חשמלי בתמיסה מימית גורם לשינויים בחומרים שבתמיסה.
- לאטומי כלור שבתמיסה יש מטען שלילי, והם נמשכים לאלקטרודה החיובית.
- לאטומי הנחושת שבתמיסה יש מטען חיובי, והם נמשכים לאלקטרודה השלילית.
*150*
נשאלת השאלה, כיצד הופכים אטומים של יסוד כלשהו לאטומים בעלי מטען חשמלי? שכן למדנו, כי בכל אטום שווה מספר האלקטרונים למספר הפרוטונים שבו, כלומר - מספר המטענים השליליים באטום שווה למספר המטענים החיוביים שבו.
(בספר איור, היעזר במנחה)
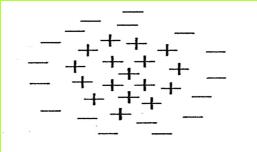
לפניכם איור של אטום כלור. בגרעינו 17 פרוטונים.
סביב הגרעין נעים 17 אלקטרונים.
מספר המטענים השליליים שבו שווה למספר המטענים החיוביים שבגרעינו.
במצב זה אטום הכלור הינו אטום נייטרלי.
באטום של נחושת יש 29 פרוטונים ו-29 אלקטרונים.
מספר המטענים החיוביים שווה למספר המטענים השליליים, על כן אטום הנחושת הינו אטום נייטרלי.
התבוננו באיורים שבעמוד 124. האם מוצגים שם אטומים נייטרליים? נמקו.
המטען החשמלי של אטום נייטרלי שווה ל-0.
הנה מספר דוגמאות: (בספר איור, היעזר במנחה)
מבנה של אטום מימן שמטענו החשמלי שווה 0.
מבנה של אטום ליתיום שמטענו החשמלי שווה 0.
*151*
קורה, שאלקטרון אחד או יותר מתרחקים מהאטום למרחק שבו אין הם מושפעים יותר מכוח המשיכה החשמלית, הקיים בין המטען החיובי של הגרעין לבין המטען השלילי של האלקטרון. במצב כזה ניתק האלקטרון מהאטום. האטום שאיבד את האלקטרון, איבד מטען חשמלי שלילי אחד. כתוצאה מכך הופר האיזון החשמלי, ומספר המטענים השליליים באטום פחת בהשוואה למספר המטענים החיוביים שבגרעינו.
אפשר לבטא זאת על ידי האיורים הבאים:
(בספר איור, היעזר במנחה)
א. בדוגמה זו נלקח מאטום הליתיום אלקטרון אחד, ולכן נותרו לו 2 אלקטרונים. כתוצאה מכך הוא נטען במטען חיובי אחד.
ב. בדוגמה זו נלקחו מאטום המגנזיום 2 אלקטרונים, ולכן נותרו לו 10 אלקטרונים.
כתוצאה מכך הוא נטען בשני מטענים חיוביים.
ג. בדוגמה זו נלקח מאטום כסף אלקטרון אחד, ונשארו לו 46 אלקטרונים. כתוצאה מכך הוא נטען במטען חיובי אחד.
ישנם מקרים, שבהם נוסף אלקטרון או מספר אלקטרונים לאטום. כתוצאה מכך עולה מספר האלקטרונים על מספר הפרוטונים שבאטום. גם במקרים אלה מופר המאזן החשמלי באטום.
א. מה יהיה מטענו החשמלי של אטום כזה, חיובי או שלילי? נמקו.
ב. לפניכם ארבע דוגמאות:
(בספר איור, היעזר במנחה)
1. בדוגמה זו יש לאטום המימן אלקטרון אחד עודף על מספר המטענים החיוביים שבו. על כן האטום טעון במטען שלילי אחד.
ציינו מהו המטען החשמלי בכל אחד משלוש הדוגמאות הבאות והסבירו כיצד קבעתם זאת.
2. אטום חמצן טעון: 10(-), 8(+)
3. אטום כלור טעון: 17(+), 18(-)
4. אטום פלואור טעון: 9(+), 10(-)
*152*
דוגמה לשינויים שבהם אטומים הופכים לאטומים טעונים, היא כאשר אטומי כלור מתנגשים באטומי נחושת. בהתנגשויות כאלה עשויים אלקטרונים לעבור מאטומי הנחושת לאטומי הכלור. כתוצאה ממעבר אלקטרון מאטום של נחושת לאטום של כלור חל שינוי במטען החשמלי של שני האטומים. אטום הכלור נטען במטען שלילי ואטום הנחושת נטען במטען חיובי.
מכיוון שבין מטענים חשמליים שונים יש משיכה חשמלית, נמשכים עתה אטומי הנחושת שמטענם חיובי לאטומי הכלור שמטענם שלילי. כך נוצרת התרכובת נחושת כלורית, תרכובת הבנויה מיונים.
(בספר איור, היעזר במנחה)
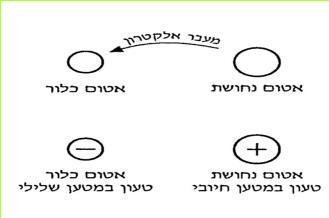
אטום טעון במטען חשמלי נקרא יון.
אטום טעון במטען חיובי נקרא יון חיובי.
אטום טעון במטען שלילי נקרא יון שלילי.
כבר ראינו, כי בעת ההמסה במים מתרחקים חלקיקי הנחושת הכלורית אלה מאלה, והם מוקפים בחלקיקי מים.
(בספר איור, היעזר במנחה)

*153*
א. כיצד אפשר לכנות את חלקיקי הכלור שבתמיסה? יונים או אטומים? נמקו.
ב. יון פירושו נודד. האם תוכלו להסביר את מקור השם?
ג. מה יקרה, אם נחליף את חיבור האלקטרודות להדקים? (כלומר: ההדק השלילי יהיה מעתה מחובר לאלקטרודה, שהייתה מחוברת קודם להדק החיובי, ולהפך.) נמקו.
ד. האם קיימת גם דחייה חשמלית בין החלקיקים שבתמיסה ובין האלקטרודות? הסבירו את תשובתכם.
ה. עיינו בתרשימים א-ח המובאים כאן, ורשמו מי מהם מתאר אטום נייטרלי, ומי מתאר יון חיובי או יון שלילי.
(בספר שמונה איורים, היעזר במנחה)
א. (היעזר במנחה)
ב. (היעזר במנחה)
ג. (היעזר במנחה)
ד. בגרעין 8 פרוטונים מסביבו 8 אלקטרונים
ה. בגרעין 8 פרוטונים מסביבו 10 אלקטרונים
ו. בגרעין 20 פרוטונים מסביבו 18 אלקטרונים.
ז. (היעזר במנחה)
ח. בגרעין 29 פרוטונים מסביבו 28 אלקטרונים.
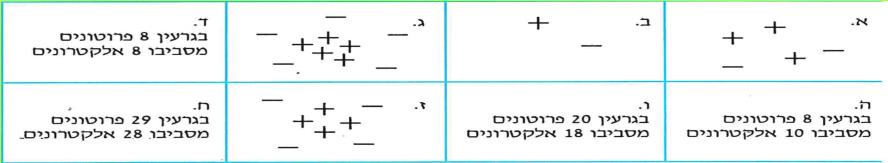
*153*
בניסויים שונים נתגלה, כי הפרוטונים קבועים במרכז האטום ואינם ניתקים ממנו. מכאן, שמספר הפרוטונים באטום של יסוד הוא מספר קבוע. פרוטונים אינם ניתקים מהאטום ואינם מיתוספים לאטומים אחרים. (עובדה זו אינו מתייחסת למקרה של תגובות גרעיניות, המתרחשות בתוך כוכבים אן במאיצי חלקיקים או בכור אטומי.) לעומת זאת ראינו, כי מספר האלקטרונים באטום עשוי להשתנות (מהמספר הקיים באטום הנייטרלי). אלקטרונים יכולים לעבור מאטום של יסוד אחד לאטום של יסוד אחר. שינויים כאלה ראינו בעת יצירתם של יונים שליליים ויונים חיוביים. מאחר שמספר האלקטרונים באטום של היסוד עשוי להשתנות, ובכל זאת היסוד אינו משתנה, הרי שמספר האלקטרונים אינו יכול לשמש כמספר זיהוי של היסוד.
לעומת זאת, מספר הפרוטונים הינו מספר קבוע ואופייני לכל אטום של כל יסוד ויסוד. לכן יכול מספר הפרוטונים לשמש כמספר הזיהוי של היסוד. ואומנם, מספר הפרוטונים באטום משמש כמספר האטומי של היסוד, והוא בעצם מספר הזיהוי של היסוד.
*154*
ז. השלימו את החסר בטבלה:
שם היסוד | מספרו האטומי | מספר הפרוטונים | מספר האלקטרונים |
אלומיניום | -- | 13 | -- |
הליום | 2 | -- | -- |
סידן | -- | -- | 20 |
גפרית | 16 | -- | -- |
נחושת | -- | -- | 29 |
*154*
מהתופעות שפגשנו בעבודות הקודמות, עולות מספר שאלות:
א. מדוע תמיסה מימית של נחושת כלורית מוליכה זרם, ותמיסה מימית של סוכר אינה מוליכה זרם?
ב. מדוע מים מזוקקים אינם מוליכים זרם?
ג. כידוע, הזרם החשמלי במוליך מתכתי הוא זרם של אלקטרונים חופשיים. האם הזרם, העובר בתמיסות מוליכות זרם, הוא גם זרם של אלקטרונים חופשיים?
בעקבות המשיכה החשמלית בין היונים לבין האלקטרודות, נעים היונים השליליים ממקום הימצאם בתמיסה לעבר האלקטרודה החיובית, והיונים החיוביים נעים לעבר האלקטרודה השלילית.
התנועה של היונים השונים בתמיסה אל האלקטרודה המתאימה היא הדרך, שבה עובר הזרם החשמלי בתמיסה. הזרם החשמלי בתמיסה הוא זרם של יונים.
מעבר זרם חשמלי בתמיסה הוא תנועה של יונים שליליים לעבר האלקטרודה החיובית, ותנועה של יונים חיוביים לעבר האלקטרודה השלילית.
*155*
(בספר איור, היעזר במנחה)
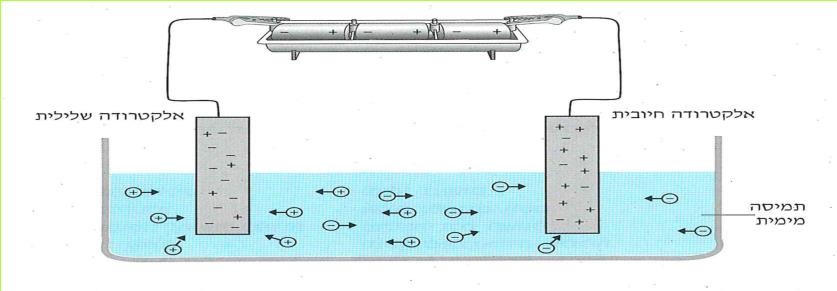
לפי עובדות אלו נוכל להניח שתמיסה מימית של חומר, המכילה יונים שליליים ויונים חיוביים, תעביר זרם חשמלי, ואילו תמיסה מימית של חומר אחר שאינה מכילה יונים שליליים ויונים חיוביים - לא תעביר זרם חשמלי.
המים המזוקקים לא העבירו זרם חשמלי, משום שאינם מכילים יונים שליליים ויונים חיוביים.
ד. שערו, לאור מה שלמדתם עד כה, מדוע התמיסה המימית של הסוכר לא הוליכה זרם חשמלי.
במי הברז או במי הים יש מומסים שונים. חלק מהחומרים המומסים מופיעים במים אלה כיונים. נוכחותם של היונים במים היא המאפשרת את הולכת הזרם.
אלקטרוליטים הם חומרים שתמיסתם המימית מוליכה זרם חשמלי, משום שתמיסה מימית של אלקטרוליט מכילה יונים שליליים ויונים חיוביים.
*156*
א. תלמידים עומדים לערוך ניסוי, כדי לקבוע אם עובר זרם חשמלי בכמה תמיסות מימיות. אילו מבין הכלים המפורטים להלן דרושים להם?
אמפרמטר; תרמומטר; מאזניים; סוללה; כוס; מוליכים; שעון עצר; נורה; אלקטרודות.
נמקו את בחירתכם.
ב. בין המילים שבטור א' ובין המילים שבטור ב' יש קשר מסוים. העתיקו את טור א' למחברתכם ורשמו ליד כל שורה את המתאים לה מטור ב'.
1. אלקטרוליט
2. אלקטרון
3. תמיסת נחושת כלורית
4. יון שלילי
5. יון חיובי
6. אלקטרודה
נמצא באטום
אליה נמשכים יונים
מוליכה זרם חשמלי.
נמשך לאלקטרודה שלילית.
נמשך לאלקטרודה חיובית.
חומר שתמיסתו המימית מכילה יונים.
ג. תלמיד ערך ניסוי, בדרך המתוארת באיור שלפניכם, והגיע למסקנה, שמים מזוקקים מוליכים זרם חשמלי. היכן. שגה?
(בספר איור, היעזר במנחה)
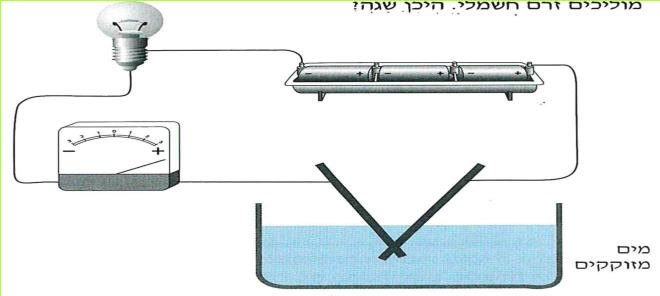
*157*
ד. תלמיד הרכיב מעגל חשמלי בדרך המתוארת באיור הבא:
(בספר איור, היעזר במנחה)
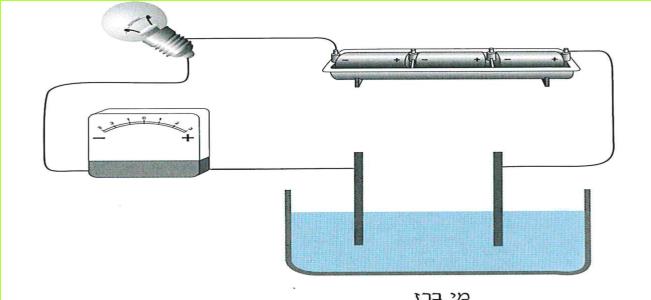
הנורה לא נדלקה, ומחוג האמפרמטר לא הראה על מעבר זרם. התלמיד הגיע למסקנה, שמי הברז אינם מוליכים זרם חשמלי. מסקנה זו אינה נכונה. באמצעות איזה מכשיר שהכרתם בכיתה ניתן להוכיח, שמי ברז הם תמיסה אלקטרוליטית?
ה. מדוע מי ים מוליכים זרם חשמלי בעוצמה גדולה ממי ברז?
*158*
- יון הוא אטום הטעון במטען חשמלי, ואילו אטום הוא נייטרלי מבחינה חשמלית.
- הזרם החשמלי בתמיסה מימית הוא תנועה של יונים לכיוון האלקטרודות המתאימות.
*158*
על המגש שלפניכם יש:
א. אבקה של אבץ ברומי.
ב. תמיסה מימית של אבץ ברומי בשתי כוסות בישול.
ג. שתי אלקטרודות פחם השקועות באחת משתי הכוסות.
(בספר תמונה, היעזר במנחה)
תמיסה מימית של אבץ ברומי ובה שקועות שתי אלקטרודות פחם
סגרו את המעגל החשמלי. צפו בשינויים המתרחשים ליד האלקטרודות בעת מעבר הזרם החשמלי בתמיסה. לאחר כשתי דקות פתחו את המעגל והוציאו את האלקטרודה השלילית.
א. מהו צבע החומר ששקע עליה?
ב. האם גם האלקטרודה החיובית צופתה באותו החומר? אם לא, מהו צבע החומר שהופיע לידה?
ג. מנין, לדעתכם, הגיעו שני החומרים לאלקטרודות?
ד. האם תוכלו לשער, מהם החומרים שהופיעו על גבי האלקטרודות?
ה. התבוננו באבקה של החומר אבץ ברומי. האם יש בה צבע אפור, המאפיין את היסוד אבץ? היש בה צבע חום, המאפיין את היסוד ברום?
ו. מהו צבע התמיסה המימית של אבץ ברומי? היש בה צבע אפור, המאפיין את היסוד אבץ? האם יש בה צבע חום, המאפיין את היסוד ברום?
ז. האם יש דמיון בין החומרים, שהתקבלו על האלקטרודות, לבין החומר המומס בתמיסה המימית? נמקו.
*159*
ראינו, כי קיימים הבדלים בין החומר בתמיסת האבץ הברומי לבין היסודות ברום ואבץ. הבדלים אלה מלמדים אותנו, כי תכונותיו של אלקטרוליט המומס במים שונות מהתכונות של היסודות שלו.
היסודות אבץ וברום הופיעו כאטומים נייטרליים, רק לאחר שעבר זרם חשמלי בתמיסה המימית של החומר אבץ ברומי. לפני מעבר הזרם החשמלי לא הופיעו ברום ואבץ על גבי האלקטרודות.
ח. על גבי איזו אלקטרודה הופיע היסוד אבץ?
ט. על גבי איזו אלקטרודה הופיע היסוד ברום?
י. האם תופעות אלו היו מתרחשות, לו היו אטומי אבץ ואטומי ברום נייטרליים? נמקו!
יא. בתמיסה מימית של אבץ ברומי, מי היון השלילי? ומיהו היון החיובי?
יב. לאיזה יון היה חסר באלקטרונים, ולאיזה יון היה עודף באלקטרונים?
כדי שיון שלילי יהפוך לאטום נייטרלי יש לגרוע ממנו את עודף האלקטרונים שבו.
כדי שיון חיובי יהפוך לאטום נייטרלי, עליו לקחת אלקטרונים כמספר האלקטרונים החסרים לו.
תחילה נכיר את רכיביו של המעגל החשמלי, הקשורים בתהליך הפיכת היונים לאטומים נייטרליים.
א. התבוננו באיור א' וציינו את שמות רכיבי המעגל; היעזרו במספרים שליד הרכיבים השונים.
(בספר איור, היעזר במנחה)
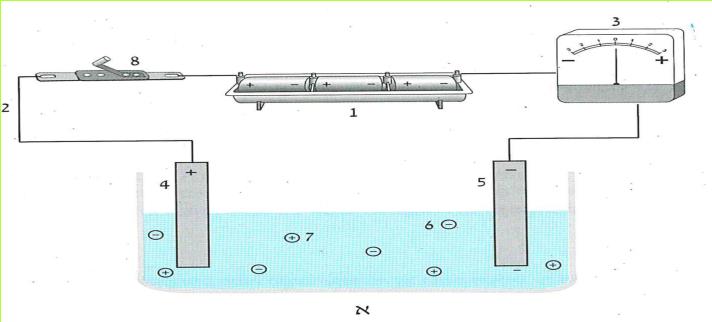
*160*
ב. לפניכם שני איורים של מעגל חשמלי (ב' ג'). באיזה משני איורים אלה המעגל סגור? כיצד אתם יודעים זאת?
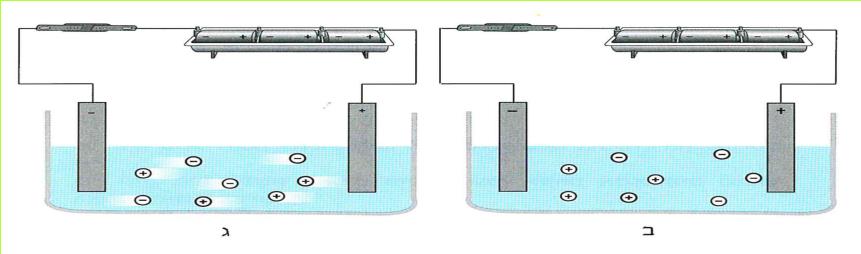
ג. באיזו אלקטרודה היה בתחילת הניסוי חוסר באלקטרונים?
ד. באיזו אלקטרודה היה בתחילת הניסוי עודף באלקטרונים?
האלקטרונים העודפים נלקחים מהיונים השליליים על ידי האלקטרודה החיובית. מהאלקטרודה החיובית הם זורמים בה כאלקטרונים חופשיים אל ההדק החיובי של הסוללה.
מההדק השלילי של הסוללה נעים אלקטרונים חופשיים אל האלקטרודה השלילית. (אין מעבר של אלקטרונים ממוט הפחם שבסוללה אל ההדק השלילי של הסוללה.)
על גבי האלקטרודה השלילית מתהווה עודף אלקטרונים. היונים החיוביים נמשכים אל האלקטרודה השלילית ולוקחים ממנה את האלקטרונים החסרים להם. בדרך זו נוצר זרם של אלקטרונים חופשיים במוליכים המתכתיים שבמעגל, ואילו בתמיסה מתרחשת נדידה של יונים לאלקטרודות המתאימות.
*161*
(בספר איור, היעזר במנחה)
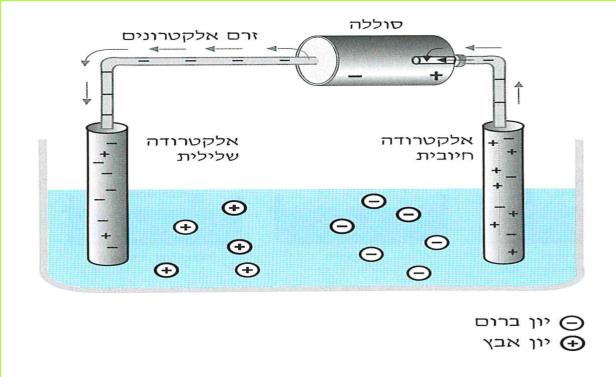
מיוני הברום נלקחו אלקטרונים עודפים, ויוני הברום הפכו לאטומים נייטרליים.
יוני האבץ לקחו אלקטרונים, שחסרו להם, והפכו לאטומים נייטרליים.
תפקיד האלקטרודה במעגל החשמלי שלפנינו הוא לקשר בין שני החלקים העיקריים של המעגל החשמלי: (א) מוליכים מוצקים (ב) תמיסה מימית של האלקטרוליט.
האלקטרודות הם הקצוות של המוליכים המוצקים, הבאים במגע עם התמיסה. דרך האלקטרודה השלילית יוצאים אלקטרונים חופשיים אל היונים החיוביים שבתמיסה. ואילו דרך האלקטרודה החיובית נכנסים אלקטרונים חופשיים מהיונים השליליים שבתמיסה.
אלקטרודה היא הדק חשמלי.
*162*
א. באיור הבא מתואר מעגל, שחלקיו עשויים חומרים שונים. באילו מהם זורמים אלקטרונים בלבד? באילו זורמים יונים?
(בספר איור, היעזר במנחה)
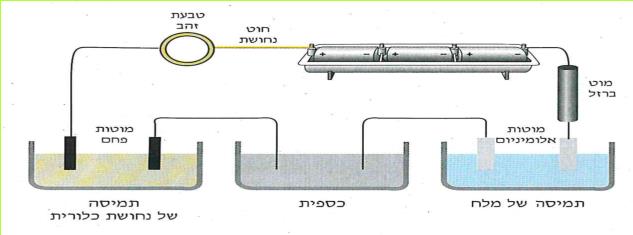
בניסוי אחר העבירו זרם חשמלי דרך תמיסה מימית של נחושת כלורית, במשך זמן ממושך. לפני הניסוי נמדדה המסה של האלקטרודות העשויות פחם. מסתן נמדדה גם אחרי הניסוי, ונמצאה עלייה במסה של אחת האלקטרודות.
ב. המסה של איזו אלקטרודה עלתה? הסבירו את התופעה.
ג. כאשר שתי אלקטרודות טובלות בתמיסה מימית של אלקטרוליט ונוגעות זו בזו, עובר במעגל זרם חשמלי, אך היונים אינם הופכים לאטומי נייטרלים. נסו להסביר מדוע.
(בספר איור, היעזר במנחה)
*163*
ד. באיור שלפניכם 4 חצים. מה מסמל כל חץ?
(בספר איור, היעזר במנחה)
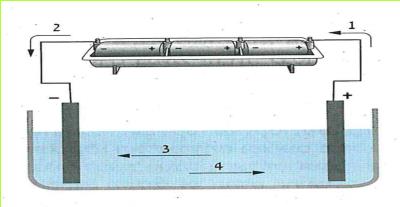
ה. מה קורה באלקטרודה החיובית בהשפעת הסוללה?
ו. מה קורה באלקטרודה השלילית בהשפעת הסוללה?
ז. בניסוי ההולכה בתמיסות המסנו כמות מסוימת של אלקטרוליט במים מזוקקים. האם, לדעתכם, תימשך הזרימה במעגל ללא קץ? נמקו!
ח. הסבירו כיצד הופך יון שלילי לאטום נייטרלי בעת מעבר זרם חשמלי בתמיסה מימית.
ט. הסבירו כיצד הופך יון חיובי לאטום נייטרלי בעת מעבר זרם חשמלי בתמיסה מימית.
י. מהו ההבדל בין מים מזוקקים לבין מי ברז?
*164*
*164*
כידוע, משך הזמן שהסוללה יכולה לפעול הוא מוגבל. אחרי שימוש ממושך הסוללה נחלשת, ועוצמת הזרם במעגל יורדת. לבסוף נפסקת פעולת הסוללה, וזרם האלקטרונים במעגל החשמלי נפסק. על סוללה במצב זה אומרים: "הסוללה נגמרה" או "הסוללה התרוקנה".
שגיתם אם חשבתם, שהסוללה התרוקנה מאלקטרונים. למדנו, שהסוללה אינה "מחסן" של אלקטרונים, אלא האלקטרונים נמצאים במוליכים.
כאשר המוליכים מחוברים למעגל חשמלי, האלקטרונים החופשיים נעים בתוכם בכיוון אחד בלבד - מההדק השלילי אל ההדק החיובי.
כאשר המוליכים אינם מחוברים למעגל החשמלי, האלקטרונים החופשיים מתנועעים בתוכם בכיוונים שונים.
א. האלקטרונים החופשיים נמצאים במוליכים ולא בסוללה.
ב. האלקטרונים החופשיים נמצאים בתנועה מתמדת, גם כאשר המעגל פתוח וגם כאשר המעגל סגור.
ג. תפקיד הסוללה לגרום לכך שתנועת האלקטרונים החופשיים תהיה בכיוון אחד בלבד.
כדי לענות על שאלה זו נכיר תחילה את מבנה הסוללה ואת פעולתה.
תיאור זה מתייחס לסוללות פשוטות, שבהן משתמשים להפעלת פנס כיס, ווקמן וכדומה.
הסוללה בנויה משני חלקים מרכזיים:
1. מוט פחם המוקף בעיסה של חומר, הנקרא מנגן דו חמצני.
2. מיכל גלילי העשוי מהמתכת אבץ, שאליה צמודה עיסה של חומר אחר - אמוניום כלוריד.
החלקים האלה הם חלקים נפרדים (ראו איור א'): כדי שהשימוש בסוללה יהיה נוח, צירפו את שני החלקים הנפרדים לגוף אחד (ראה איור ב'). כדי להמשיך ולשמור על ההפרדה הכניסו ביניהם מחיצה.
*165*
א. שני החלקים המרכזיים של הסוללה
(בספר שלושה איורים, היעזר במנחה)
1. מוט פחם ועיסה של מנגן דו - חמצני
2. מיכל אבץ ובו עיסה של אמוניום כלוריד
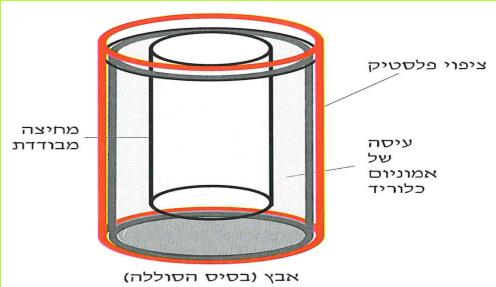
ב. הסוללה כגוף אחד
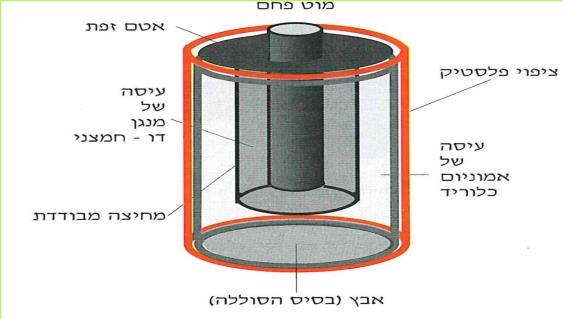
*166*
בסוללה תקינה מצוי עודף אלקטרונים בהדק השלילי, ואילו בהדק החיובי קיים מחסור באלקטרונים (ראה איור ג').
(בספר איור, היעזר במנחה)
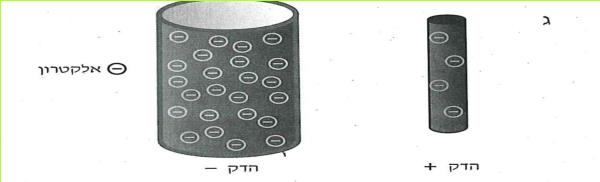
כאשר מחברים את הסוללה למעגל חשמלי הופכת התנועה הבלתי מסודרת של האלקטרונים במוליכים לתנועה מסודרת בכיוון אחד, מההדק השלילי להדק החיובי (ראו איורים ד' ה').
(בספר איור, היעזר במנחה)
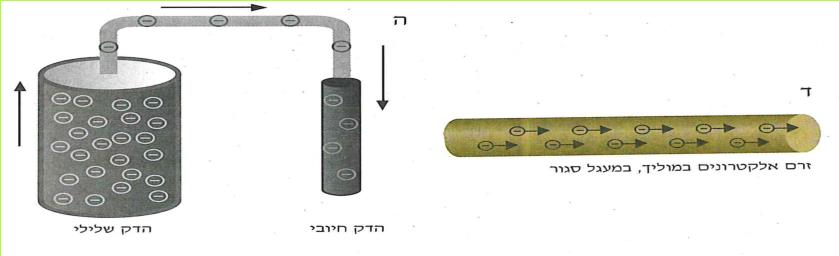
בהדק החיובי קיים מחסור באלקטרונים. כתוצאה ממחסור זה נמשכים האלקטרונים החופשיים שבמוליך אל ההדק החיובי. את מקום האלקטרונים, שזרמו להדק החיובי, תופסים אלקטרונים אחרים, המגיעים מההדק השלילי. בדרך זו נוצרת זרימה של אלקטרונים בכיוון אחד, מההדק השלילי אל ההדק החיובי.
*167*
אמרנו, כי הסוללה אינה משמשת כמחסן של אלקטרונים. אם כך, כיצד נוצר מצב, שבו הדק אחד מכיל אלקטרונים רבים? על כך נענה בעזרת התיאור הבא: כתוצאה מהמגע בין דופן הגליל לבין עיסת החומרים הצמודה אליו (ראו איור א') מתמוסס בעיסה חלק מהאבץ. האלקטרונים, שהיו בחלק שהתמוסס, עוזבים אותו ועוברים לאזורים אחרים של מיכל האבץ, ולא לחומרים שבעיסה. בדרך זו הולכים ומצטברים אלקטרונים רבים על דפנות מיכל האבץ, שעדיין לא התמוססו (ראו איור ו').
(בספר איור, היעזר במנחה)
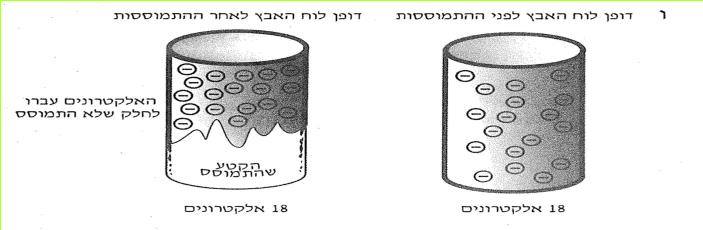
בגלל תגובה כימית בין מוט הפחם לבין העיסה הצמודה אליו עוזבים אלקטרונים את מוט הפחם, ומוט הפחם הופך להדק חיובי.
איור ז' מתאר את ההתרחשות בסוללה עד כה.
(בספר איור, היעזר במנחה)
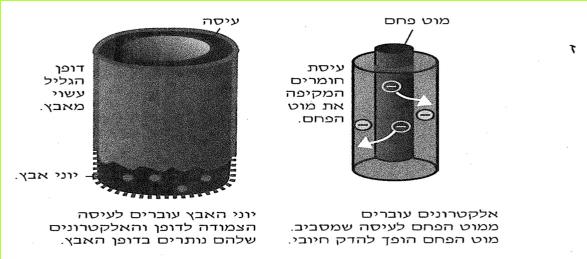
*168*
(בספר איור, היעזר במנחה)
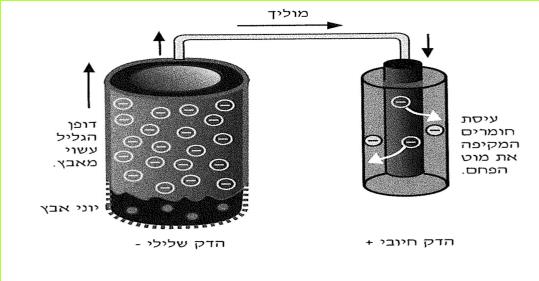
כאשר נחבר את ההדק השלילי אל ההדק החיובי באמצעות מוליך, יווצר זרם של אלקטרונים מההדק השלילי להדק החיובי.
בגלל התמוססות האבץ ובגלל מעבר האלקטרונים ממוט הפחם לחומרים שבעיסה, חלק מכמות החומרים המקוריים שהיו בשתי העיסות השונות, הופך לחומרים אחרים.
החומרים החדשים שנוצרים אינם יכולים לגרום לאותן תוצאות, כלומר, למעבר אלקטרונים מדופן האבץ אל מוט הפחם. לכן, לאחר שימוש רב בסוללה, נותרת כמות קטנה מהחומרים המקוריים ופעולת הסוללה נחלשת. החומרים החדשים שנוצרים עלולים לגרום נזק למכשיר החשמלי. הנזק נגרם, בדרך כלל, בעקבות הרס דופן הגליל, בגלל התמוססות רבה של האבץ ודליפה של חומרים לתוך בית הסוללה שבמכשיר החשמלי.
גם סוללה שנשמרה זמן רב בלא שימוש, מאבדת במשך הזמן את יכולת פעולתה. זאת, מכיוון שבחומרים שבסוללה מתרחשים שינויים שונים במהלך הזמן. ככל שהטמפרטורה של הסביבה שבה נמצאת הסוללה יותר גבוהה, השינויים המתרחשים בתוכה יותר מהירים.
ניתן להאט את קצב השינויים האלה על ידי אכסון הסוללות בטמפרטורה נמוכה. בצבא מאכסנים את הסוללות בטמפרטורה של -20 מעלות צלזיוס. בתנאים אלה ניתן לשמור על הסוללות במשך שלוש שנים.
*169*
א. מהו תפקיד הסוללה במעגל החשמלי?
ב. כיצד יודעים שהסוללה "הולכת ונגמרת"?
ג. לו היה ניתן לחדש את פעולת הסוללה, מה הייתם מחליפים בסוללה המשומשת?
ד. היכן עדיף לאכסן סוללות רזרביות, על השולחן בחדר או במקרר? נמקו.
ה. מהי הטעות במשפט: "בלוח האבץ שבסוללה נוצרו אלקטרונים חדשים"?
ו. הסבירו: מדוע הסוללה "נגמרת" מהר יותר, כאשר במעגל החשמלי אין מכשיר חשמלי? (רמז - נוכחות של מכשיר חשמלי במעגל מגדילה את התנגדותו.)
ז. האם מוכרות לכם סוללות, שניתן לעשות בהן שימוש חוזר? אם כן, כיצד הן נקראות?
ח. אם למדתם על תופעת הקצר, הסבירו מדוע לא רצוי לחבר את הדקי הסוללה בצורה הבאה:
(בספר איור, היעזר במנחה)

*169*
בדומה לפעולת הסוללה הרגילה פועלת גם "סוללה מלימון". הבה נבדוק זאת.
א. חברו חוט מוליך לכל אחד משני הדקי המיקרו- אמפרמטר (ראו תצלום).
ב. לקצה של החוט האחד חברו פס אבץ, ולקצה של החוט השני חברו פס נחושת.
ג. גלגלו לימון גדול על השולחן ולחצו עליו בכוח, כדי לאפשר לנוזל שבשקיות המיץ לצאת מתוכן.
ד. תקעו את שני פסי המתכת בלימון. התבוננו במחוג המיקרו-אמפרמטר. על מה מעידה תנועתו של המחוג?
(בספר איור, היעזר במנחה)

*170*
ה. חזרו על הניסוי עם פקעת תפוח אדמה. האם קיבלתם תוצאות דומות?
פס האבץ ופס הנחושת ממלאים את התפקיד, שמילאו פס האבץ ומוט הפחם בסוללה.
מיץ הלימון שבלימון או החומצה שבתפוח האדמה פועלים בדומה לעיסת החומרים בסוללה. ואולם בסוללה מצוי חומר נוסף, המאפשר לה לפעול במשכי זמן ארוכים יותר.
ו. ראיתם, כי ניתן להפעיל מיקרו-אמפרמטר על ידי חיבורו ללימון אחד. ומה עם הדלקת נורה? האם אפשר להדליק נורה על ידי לימונים? הנה לפניכם הצעת ניסוי!
מה דעתכם לנסות?
(בספר 2 איורים, היעזר במנחה)

הערה: כדי שהניסוי יצליח, חשוב להקפיד שפסי המתכת יהיו נקיים. רצוי לשייף אותם מעט בצמר ברזל.
*170*
מי זה החכם שמכניס תפוחי אדמה לתוך שעון?!
דבר אחד בטוח, זה אינו ילד שובב, אלא דווקא מישהו רציני, שהקדיש מחשבה וכוונות חיוביות לעניין, ולולא תחב את תפוחי האדמה - לא היה השעון הזה קיים כלל!
כי זהו בדיוק העניין: לוקחים שני תפוחי אדמה בגודל בינוני, מחברים אותם לחוטים המתאימים ו... יש! השעון פועל! איך זה קורה? פשוט מאוד, מתברר שבזכות החומצה הטבעית שבתפוחי האדמה נוצר זרם חשמלי. לא הרבה, אמנם, אבל די כדי להפעיל את השעון.
והשעון הזה, אגב, איננו סתם שעשוע פרטי. בארצות הברית, למשל, ניתן להשיגו בחנויות.
*171*
*171*
א. אטום שבו מספר המטענים השליליים שווה למספר המטענים החיוביים הוא אטום נייטרלי מבחינה חשמלית.
ב. אטום שבו מספר המטענים השליליים קטן ממספר המטענים החיוביים הוא אטום טעון במטען חיובי, ונקרא יון חיובי.
ג. אטום שבו מספר המטענים השליליים גדול ממספר המטענים החיוביים הוא אטום טעון במטען שלילי, ונקרא יון שלילי.
ד. מספר הפרוטונים בגרעין הוא המספר האטומי של היסוד.
ה. תמיסות מימיות המכילות יונים, מוליכות זרם חשמלי.
ו. הזרם החשמלי בתמיסה הוא תוצאה של:
1. תנועת יונים שליליים לעבר האלקטרודה החיובית ותנועת יונים חיוביים לעבר האלקטרודה השלילית.
2. מעבר אלקטרונים מהיונים השליליים לאלקטרודה החיובית, ומעבר אלקטרונים מהאלקטרודה השלילית ליונים החיוביים.
ז. תמיסות מימיות, שאינן מכילות יונים, אינן מוליכות זרם חשמלי. לדוגמה: תמיסת סוכר.
ח. כמוליכים המתכתיים זורמים אלקטרונים חופשיים. בתמיסה מימית של אלקטרוליט נודדים היונים לעבר האלקטרודות המתאימות.
ט. מיון שלילי נלקח אלקטרון לאלקטרודה חיובית, ויון חיובי לוקח אלקטרון מאלקטרודה שלילית. בדרך זו הופכים שני היונים לאטומים נייטרליים.
י. מעבר זרם חשמלי במוליך מתכתי אינו גורם לשינוי בתכונות המוליך.
יא. בעת מעבר זרם חשמלי בתמיסה מימית של אלקטרוליט, האלקטרוליט מתפרק לחומרים חדשים.
יב. יש הבדל ניכר בין תכונות החומרים המתקבלים ליד האלקטרודות, לבין תכונות האלקטרוליט שבתמיסה. זאת מכיוון שהחומרים החדשים בנויים מאטומים, ואילו האלקטרוליט מורכב מיונים.
*171*
א. מספר אטומי הוא:
1. מספר הפרוטונים באטום.
2. מספר שניתן שרירותית לכל אטום.
3. מספר האלקטרונים באטום.
4. מספר האלקטרונים והפרוטונים באטום.
ב. המספר האטומי של הברזל הוא 26. כלומר באטום ברזל אחד יש:
1. 13 אלקטרונים ו-13 פרוטונים.
2. 26 פרוטונים ו-26 אלקטרונים.
3. 26 אלקטרונים ופרוטון אחד.
4. 26 פרוטונים ואלקטרון אחד.
*172*
ג. אטום טעון חיובית נוצר על ידי:
1. הוספת פרוטונים לאטום נייטרלי.
2. הרחקת אלקטרונים מאטום נייטרלי.
3. הוספת אלקטרונים לאטום נייטרלי.
4. הרחקת פרוטונים מאטום נייטרלי.
ד. רשמו מתחת לכל איור: אטום נייטרלי/ יון חיובי/ יון שלילי.
(בספר חמישה איורים, היעזר במנחה)
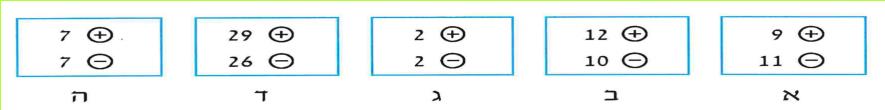
ה. יון הוא אטום שבו:
1. מספר הפרוטונים שווה למספר האלקטרונים.
2. מספר האלקטרונים גדול או קטן ממספר הפרוטונים.
3. מספר הנייטרונים שווה למספר האלקטרונים.
4. מספר הנייטרונים גדול או קטן ממספר הפרוטונים.
ו. המיסו במים אבקת כביסה. כיצד ניתן לבדוק אם בתמיסה זו יש יונים?
ז. סוכר מתמוסס במים. התמיסה אינה מוליכה חשמל. איזה משפט מבין המשפטים הבאים מסביר נכון עובדה זו?
1. אין הולכה של זרם חשמלי, כי בתמיסה יש רק יונים חיוביים.
2. אין הולכה של זרם חשמלי, כי בתמיסה יש רק יונים שליליים.
3. אין הולכה של זרם חשמלי, כי בתמיסה אין יונים חיוביים ושליליים.
4. אין הולכה של זרם חשמלי, כי בתמיסה יש יונים חיוביים ושליליים.
ח. לפניכם רשימת חומרים. איזה מהם יוצא דופן בהולכת חשמל? נמקו. תמיסת סוכר, מים מזוקקים, תמיסת נחושת כלורית.
ט. אם יניחו לפניכם תמיסת סוכר, מי-ים ומים מזוקקים, כיצד תזהו את מי הים בלי לטעום ובלי לאייד אותם?
*173*
(בספר ארבעה איורים, היעזר במנחה)
י. בכוס המתוארת באיור, האלקטרודות אינן מחוברות לסוללה, ואין תנועה של יונים. מדוע אין מבחינים בזרימת יונים בלי מקור זרם?
1. בלי מקור זרם אין יונים בתמיסה.
2. לאלקטרודות יש אותו סוג של מטען חשמלי.
3. בלי מקור זרם האלקטרודות אינן טעונות.
4. כנראה היונים אינם טעונים במטען חשמלי.
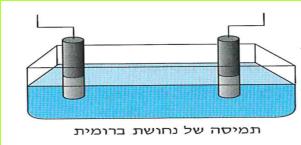
יא. באיור המתואר מתרחשת זרימת יונים. מה הסיבה לכך?
1. שתי האלקטרודות נטענו במטען חשמלי שלילי.
2. שתי האלקטרודות נטענו במטען חשמלי חיובי.
3. האלקטרודות השונות נטענו במטען חשמלי שונה.
4. נוצרו יונים בתמיסה.
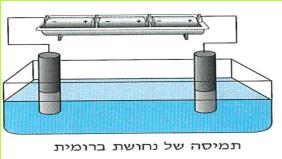
יב. 1. מה מתרחש ליד האלקטרודה החיובית באיור?
2. מה מתרחש ליד האלקטרודה השלילית?
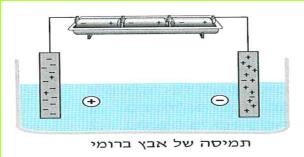
יג. עיינו באיור הבא וענו על השאלות.
1. כיצד הופך יון נחושת לאטום של נחושת?
2. מדוע יון נחושת אינו נמשך לאלקטרודה האחרת?
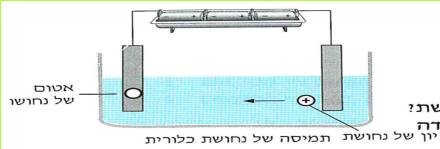
*174*
יד. באיזה מקרה מהבאים יחול שינוי בהרכב המוליך, אם מעבירים דרכו זרם חשמלי? נמקו.
1. מתכת;
2. תמיסה מימית של אלקטרוליט.
טו. באיור הבא מציינים המספרים 1 ו-2 אלקטרונים, והמספרים 3 ו-4 מציינים יונים.
העתיקו את התרשים למחברתכם וסמנו בחץ את כיוון התנועה של כל חלקיק.
(בספר איור, היעזר במנחה)
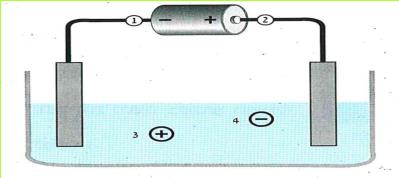
טז. במעבדה נבדקה הולכה של זרם חשמלי בשתי תמיסות.
התברר שבמעגל של תמיסה א' סטה מחוג האמפרמטר, ובמעגל של תמיסה ב' לא סטה המחוג.
העתיקו את המשפטים הבאים בצורתם הנכונה.
1. במעגל א' סטה מחוג האמפרמטר, כי עבר/לא עבר בו זרם חשמלי.
2. במעגל ב' לא סטה מחוג האמפרמטר, כי זרמו/לא זרמו יונים בתמיסה שבה יש זרם חשמלי.
3. בתמיסה א' היו/לא היו יונים חיוביים ושליליים.
4. בתמיסה ב' היה/לא היה מעבר אלקטרונים בין יונים לאלקטרודות.
יז. המיסו במים מזוקקים אבקה של נחושת כלורית. בבדיקה נמצא, שהתמיסה מוליכה חשמל. איזה משפט מסביר את המוליכות החשמלית של התמיסה?
1. כל תמיסה מוליכה חשמל.
2. בתמיסה יש יונים חיוביים ויונים שליליים.
3. בתמיסה יש נחושת, ונחושת מוליכה חשמל.
4. בתמיסה יש מים, ומים מוליכים חשמל.
יח. נמצא, כי אם מוסיפים מלח בישול למי ברז, שטבולות בהם אלקטרודות, גדלה עוצמת הזרם החשמלי. מדוע?
*175*
יט. אטומי הנחושת ביסוד נחושת שונים מאטומי הנחושת בתמיסת הנחושת הכלורית, מכיוון ש:
1. אטומי הנחושת ביסוד הם יונים חיוביים, ואילו בתמיסה הם נייטרליים.
2. אטומי הנחושת ביסוד הם נייטרליים, ואילו בתמיסה הם טעונים במטען חיובי.
3. אטומי הנחושת ביסוד אינם מכילים אלקטרונים חופשיים, ואילו בתמיסה הם מכילים אלקטרונים חופשיים.
4. אטומי הנחושת ביסוד נחושת הם טעונים, ואילו בתמיסת הנחושת הכלורית אינם טעונים.
כ. מעבירים זרם חשמלי בתמיסת נחושת כלורית. המשפטים הבאים מתארים את המתרחש בתמיסה. השלימו אותם.
1. בתמיסה יש יונים -- של נחושת, ואלה נמשכים לאלקטרודה --.
2. בתמיסה יש יונים -- של כלור, ואלה נמשכים לאלקטרודה --.
3. לפניכם רשימת מילים. רשמו אותם בהתאמה לאיור, שלמעלה.
יוני כלור, יוני נחושת, אלקטרודה חיובית, אלקטרודה שלילית, יונים חיוביים, יונים שליליים.
כא. רשמו "נכון" או "לא נכון" ליד המשפטים הבאים. כשמעבירים זרם חשמלי בתמיסת הנחושת הכלורית:
1. יוני הכלור נמשכים לאלקטרודה השלילית והופכים לאטומים נייטרליים --.
2. יוני הנחושת נמשכים לאלקטרודה השלילית והופכים לאטומים נייטרליים --.
3. על האלקטרודה החיובית מופיע הגז כלור --.
4. על האלקטרודה השלילית מצטברים אטומי נחושת --.
*176*
כב. ציינו מה מתרחש ליד האלקטרודה החיובית:
1. נלקחים ממנה אלקטרונים ליונים שליליים.
2. נלקחים ממנה אלקטרונים ליונים חיוביים.
3. היא לוקחת אלקטרונים מיונים שליליים.
4. היא לוקחת אלקטרונים מיונים חיוביים.
כג. העתיקו את המשפטים הבאים למחברתכם ורשמו "נכון" או "לא נכון" ליד כל משפט.
1. לכל היונים יש מטען חשמלי --.
2. בעת מעבר זרם חשמלי בתמיסה הופכים היונים שבתמיסה לאטומים נייטרליים --.
3. יונים חיוביים מתקבלים על ידי לקיחת אלקטרונים מאטומים נייטרליים --.
4. יון חיובי הוא אטום בעל עודף אלקטרונים --.
5. בין יון חיובי ליון חיובי קיימת משיכה חשמלית --.
6. בעת מעבר זרם חשמלי בתמיסה נמשך יון שלילי לאלקטרודה חיובית --.
7. אטום, שנלקח ממנו אלקטרון, הופך ליון שלילי --.
כד. להלן רשימה של יסודות ומספר האלקטרונים והפרוטונים שבאטומיהם. העתיקו את הרשימה ומלאו את הטור האחרון. כתבו בו, אם אטומים אלה נייטרליים, בעלי מטען חיובי או שלילי.
(ריק) | מספר הפרוטונים | מספר האלקטרונים | המטען |
מגנזיום | 12 | 10 | -- |
יוד | 53 | 54 | -- |
אלומיניום | 13 | 10 | -- |
כרום | 24 | 24 | -- |
גפרית | 16 | 18 | -- |
חנקן | 7 | 7 | -- |
*177*
כה. באטום נייטרלי:
1. מספר הפרוטונים שווה למספר האלקטרונים.
2. מספר הנייטרונים שווה למספר האלקטרונים
3. מספר הנייטרונים שווה למספר הפרוטונים.
4. מספר הפרוטונים שונה ממספר האלקטרונים
כו. ביון חיובי:
1. מספר הפרוטונים גדול ממספר האלקטרונים.
2. מספר האלקטרונים גדול ממספר הפרוטונים.
3. מספר הפרוטונים שווה למספר הנייטרונים.
4. מספר האלקטרונים שווה למספר הנייטרונים
כז. למטה ובעמוד הבא מוצגת רשימה חלקית של יסודות והמספרים האטומיים שלהם. את הרשימה השלמה תוכלו למצוא בעמודים: 297-299.
1. עיינו ברשימה. לפי איזה סדר נערכו היסודות ברשימה זו?
2. עיינו בטבלת היסודות שבעמוד 300.
האם היסודות ערוכים שם לפי אותו הסדר?
לפי איזה סדר נערכו היסודות שם?
3. האם מצאתם שני יסודות, שיש להם אותו מספר אטומי?
4. האם נכונה האמירה: "אמור לי את המספר האטומי, ואומר לך את שם היסוד?"
הסבירו!
*178*
מס' אטומי | היסוד |
1 | מימן |
2 | הליום |
3 | ליתיום |
4 | בריליום |
5 | בור |
6 | פחמן |
7 | חנקן |
8 | חמצן |
9 | פלואור |
10 | ניאון |
11 | נתרן |
12 | מגנזיום |
13 | אלומיניום |
14 | צורן |
15 | זרחן |
16 | גפרית |
17 | כלור |
18 | ארגון |
19 | אשלגן |
20 | סידן |
21 | סקנדיום |
22 | טיטניום |
23 | ונדיום |
24 | כרום |
25 | מנגן |
26 | ברזל |
27 | קובלט |
28 | ניקל |
29 | נחושת |
30 | אבץ |
31 | גליום |
32 | גרמניום |
*179*
*179*
בפרק ד' למדנו כי:
א. תרכובות שתמיסתן המימית מוליכה זרם חשמלי, מתפרקות לחומרים אחרים בעת מעבר הזרם בתמיסה. לדוגמה:
נחושת כלורית (בתמיסה מימית) (תרכובת) - פירוק על ידי זרם חשמלי - כלור (יסוד)+נחושת (יסוד)
אבץ ברומי (בתמיסה מימית) (תרכובת) - ברום (יסוד)+אבץ (יסוד)
ב. חומרים שתמיסתם המימית אינה מוליכה זרם חשמלי, אינם מתפרקים לחומרים אחרים על ידי זרם חשמלי. לדוגמה:
סוכר (בתמיסה מימית) - אין מעבר של זרם חשמלי - סוכר (בתמיסה מימית)
האם אי אפשר לפרק סוכר? ואולי אפשר לפרקו, אבל בדרך אחרת?
לפניכם מבחנה ובה מעט סוכר. המבחנה סגורה עם פקק, דרכו עובר צינור זכוכית קצר. א. חממו בזהירות את המבחנה. במקום שבו הסוכר מצוי.
שימו לב לטיפות הנוזל המצטברות על דפנות המבחנה. הרחיקו את המבחנה מהלהבה.
(בספר תמונה, היעזר במנחה)

*180*
ב. על פי המראה בלבד קשה לנו להחליט מהו הנוזל, ולכן נבדוק את זהותו על ידי בוחן למים. המונח הלועזי לחומר בוחן הוא אינדיקטור - indicator.
(בספר תמונה, היעזר במנחה)
בוחן - indicator חומר המשמש לבדיקת נוכחות של חומר מסוים.

נייר קובלט כלורי הוא חומר הבוחן מים. חומר זה משנה את צבעו מכחול לוורוד רק בנוכחות מים.
נייר קובלט כלורי כחול+מים - נייר קובלט כלורי וורוד
טבלו את נייר הבוחן בכוס מים.
1. מה אירע לנייר הבוחן?
קחו נייר בוחן נוסף, הוציאו את הפקק מהמבחנה וטבלו את נייר הבוחן בטיפות הנוזל שעל גבי דופן המבחנה.
2. מה אירע לנייר הבוחן?
3. מה מסקנתכם מכך? המשיכו לחמם את המבחנה, עד שיופיע חומר מוצק שחור.
כבו את האש והניחו למבחנה להתקרר. הוציאו את הפקק מהמבחנה. בעזרת תיל מכופף הוציאו את החומר השחור מהמבחנה לתוך צלחת. נסו לטעום ממנו מעט.
(בספר תמונה, היעזר במנחה)

*181*
האם המוצק השחור הינו סוכר? נמקו.
החומר השחור הוא פחמן. נוכל לסכם את פעולת חימום הסוכר ולומר, כי בפעולת החימום פירקנו את הסוכר למים ולפחמן.
סוכר - (חימום) - פחמן+מים
ד. ערכו השוואה בין תכונות הסוכר לתכונות החומרים שנתקבלו מפירוקו.
תכונות החומרים | החומר לפני הפירוקסוכר | החומרים שנתקבלו מפעולת הפירוקמים | החומרים שנתקבלו מפעולת הפירוקפחמן |
מצב צבירה בטמפרטורת החדר | -- | -- | -- |
טעם | -- | -- | -- |
צבע | -- | -- | -- |
ה. עיינו בטבלה שהשלמתם. האם תכונות החומרים, שנתקבלו מפעולת הפירוק, דומות לאלו של הסוכר או שונות מהן?
ו. אם מצאתם הבדלים, רשמו אותם.
ז. האם פירוק הסוכר הוא תהליך כימי? נמקו.
ח. האם נכון לומר, כי פירוק של נחושת כלורית היא תהליך כימי?
ט. לסיכום: האם פירוק של חומרים אפשרי רק בעזרת זרם חשמלי? נמקו.
*182*
- בפעולת הפירוק מפרקים חומר אחד ומקבלים חומרים אחרים.
- תכונות החומרים המתקבלים מפעולת הפירוק שונות מתכונות החומר שהתפרק.
- תהליך שבו חומר מתפרק לחומרים אחרים, נקרא תהליך כימי.
*182*
את הסוכר פירקנו על ידי פעולת חימום. אם נחמם את המים, כפי שחיממנו את הסוכר, לא נצליח לפרקם.
התוצאה היחידה מפעולת חימום המים תהיה שינוי במצב הצבירה שלהם.
מים במצב צבירה של נוזל - (חימום) - מים במצב צבירה של גז
שנים רבות חשבו המדענים, כי לא ניתן לפרק את המים. רק אחרי שהומצאו הסוללות החשמליות, הצליחו הכימאים לפרק את המים בעזרת הזרם החשמלי. גם אנחנו ננסה לפרק את המים באותה השיטה - בעזרת הזרם החשמלי.
עבודה ל"ג - פירוק מים על ידי זרם חשמלי (אלקטרוליזה של מים)
(המים שאנו מפרקים הינם מים מזוקקים. כידוע לכם, מים מזוקקים אינם מוליכים זרם חשמלי. כדי לאפשר מעבר זרם חשמלי הוסיף המורה למים מעט חומצה. החומרים החדשים שנוצרים הם מהמים בלבד.)
טבלו שני מוטות גרפיט בכוס מים (היעזרו בתצלום שלפניכם).
הקפידו, שהמוטות לא יגעו זה בזה.
סגרו את המעגל החשמלי. התבוננו במתרחש סמוך למוטות הגרפיט.
(בספר תמונה, היעזר במנחה)

*183*
א. במה אתם מבחינים?
פתחו את המעגל והמתינו מעט.
ב. האם הופעת הבועות נמשכת?
ג. כיצד ניתן, לדעתכם, לחדש את הופעתן? בדקו זאת!
ד. איזו מסקנה ניתן להעלות מחידוש הופעת הבועות?
ה. האם פירוק המים נחשב לתהליך כימי? נמקו!
כדי לבדוק את הגזים נפרק את המים במכשיר, המאפשר גם לקלוט את הגזים הנוצרים בעת הפירוק.
(בספר תמונה, היעזר במנחה)

*184*
לאחר ששתי המבחנות יתמלאו בגז, נפקוק אותן בעודן במים, נוציא את המבחנה שהתמלאה ראשונה בגז. נפתח אותה ונקרב אל פתחה קיסם דולק (ראו תצלום).
(בספר תמונה, היעזר במנחה)

א. במה הבחנתם?
גז זה הוא מימן. המימן הוא חומר דליק.
ב. איזו תופעה מעידה, כי המימן הוא חומר דליק?
נוציא את הפקק מהמבחנה השנייה ונכניס לתוכה קיסם עומם.
(בספר תמונה, היעזר במנחה)
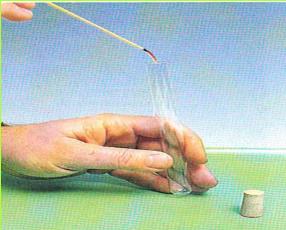
*185*
א. במה הבחנתם?
ב. איזו תכונה יש לחומר שבמבחנה זו?
הגז שבמבחנה השנייה הוא החמצן.
א. השלימו את החסר במשפט הבא:
אפשר לפרק את המים בעזרת – לשני חומרים: ל-- ול--.
ב. המים מורכבים משני גזים. מלאו את הטבלה הבאה:
התכונות | מים | חמצן | מימן |
1. מצב הצבירה בטמפרטורת החדר. | -- | -- | -- |
2. עוזר לחומרים לבעור היטב - כן/לא. | -- | -- | -- |
3. דליק - כן/לא. | -- | -- | -- |
ג. איזה מהגזים מימן וחמצן יכול לשמש כחומר דלק, ואיזה דרוש לבערתם של חומרי דלק?
פירוק מים בעזרת זרם חשמלי נקרא אלקטרוליזה של מים.
(ביוונית: אלקטרו=חשמל, ליזיס=פירוק, אלקטרוליזה=פירוק על ידי חשמל)
א. תארו את פירוק הסוכר בעזרת התרשים הבא:
(בספר תרשים, היעזר במנחה)
-- פירוק על ידי חימום --
-- פירוק על ידי חימום - מים - פירוק על ידי זרם חשמלי --
-- פירוק על ידי חימום - מים - פירוק על ידי זרם חשמלי --
*186*
א. פעם חיממנו מים ופעם העברנו במים זרם חשמלי. באיזה מקרה לא היה פירוק של המים? הסבירו!
ב. לפעמים, כאשר מתרחשת שרפה, עשוי משב רוח פתאומי ללבות את השרפה (להגביר את עוצמתה). מהי הסיבה לכך? הסבירו!
ג. לפניכם מספר תופעות. ציינו לגבי כל אחת מהן, אם התהליך שגרם להופעתן הוא תהליך כימי. נמקו את תשובתכם:
1. שינוי מצב הצבירה של מים מנוזל לקרח.
2. הופעת אדי מים על זכוכית החלון בימי החורף.
3. ציפת השומן שבחלב על פני נוזל החלב.
4. אלקטרוליזה של מים.
5. שבירה של כוס זכוכית.
6. חיתוך פרוסות לחם.
7. מעבר של זרם חשמלי במוליך מוצק.
הרחבה: פרק קריאה : שימושים באלקטרוליזה, ראו בעמודים 214-217.
*187*
- אפשר לפרק חומרים רבים.
- יש חומרים שניתן לפרקם על ידי חימום.
- יש חומרים שניתן לפרקם על ידי זרם חשמלי.
- הסוכר מתפרק לפחמן, מימן וחמצן.
*187*
אם ננסה להמשיך בפעולת הפירוק של החומרים: חמצן, מימן או פחמן, נראה כי לא נצליח בכך.
החמצן, המימן והפחמן יישארו כפי שהם, ללא כל שינוי נוסף.
הכימאים ניסו לפרק חומרים רבים נוספים והגיעו למסקנה, כי ישנם חומרים, שאי אפשר לפרק אותם.
(הפיסיקאי רוברט בויל (1627-1691) היה האיש, שהציע לתת את השם יסוד לחומרים, שלא ניתן לפרקם.)
החמצן, המימן והפחמן הם יסודות. מאילו יסודות מורכבים המים? ודאי תשאלו, מנין יודעים שחומר מסוים הינו יסוד?
מנסים לפרק אותו על ידי חימום, בעזרת זרם חשמלי וגם בדרכים אחרות. אם בכל הניסויים אין מצליחים לפרק את החומר, אפשר אז לקבוע ולומר, שהוא יסוד.
בנוסף ליסודות שהזכרנו, אפשר להוסיף גם את הנחושת, הכלור, האבץ והברום שהכרנו בשיעורים הקודמים.
הבה ננסה לברר, מדוע לא ניתן לפרק את היסודות. כדוגמה, נתייחס ליסודות נחושת ופחמן.
באיור שלפניכם מתואר המבנה האטומי של גוש נחושת המייצג את היסוד נחושת והמצב המתקבל לאחר פעולת החימום.
(בספר תרשים, היעזר במנחה)
תרשים המתאר את המבנה החלקיקי של גוש נחושת. - חימום בלא נוכחות אוויר - תרשים של אטומים בודדים וקבוצות אטומים של היסוד נחושת.
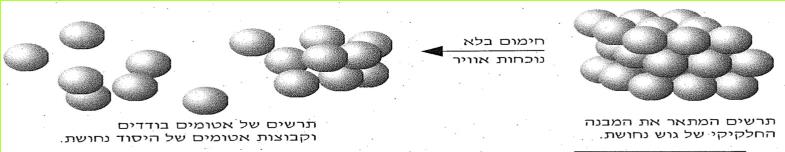
*188*
באיור הבא מתואר גוש של אטומי פחמן (יהלום) המייצג את היסוד פחמן והמצב המתקבל לאחר פעולת החימום.
עיינו בשני האיורים וענו על השאלות שאחריהם.
(בספר תרשים, היעזר במנחה)
תרשים המתאר את המבנה החלקיקי של חתיכת יהלום. - חימום בלא נוכחות אוויר - תרשים של אטומים בודדים וקבוצות אטומים של היסוד פחמן.
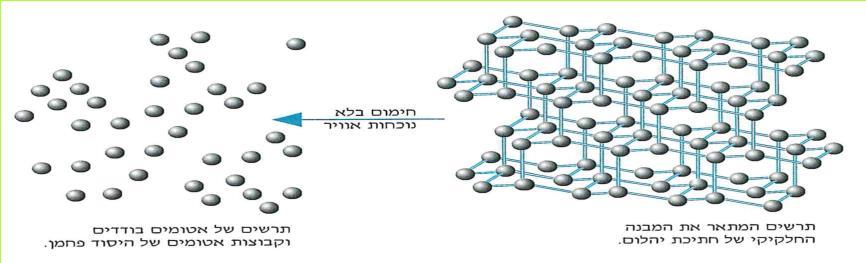
א. לו הצגנו גוש נחושת יותר גדול, במה היו שני גושי הנחושת שונים? ובמה הם היו דומים? הסבירו את תשובתכם.
ב. מהו השינוי שחל בגוש הנחושת בעקבות פעולת החימום?
ג. לפני פעולת החימום מייצג גוש הנחושת את היסוד נחושת. האם אטומים בודדים וקבוצות אטומים שהתקבלו לאחר פעולת החימום, מייצגים גם הם את היסוד נחושת? נמקו!
ד. האם נוכל לטעון, כי בעקבות פעולת החימום פירקנו את היסוד נחושת? נמקו!
ה. האם גוש יהלום מייצג יסוד? נמקו!
ו. האם לאחר חימום גוש היהלום (בלא נוכחות חמצן) נוצרו חלקיקים, שאינם מייצגים את היסוד פחמן? נמקו!
ז. עד כה פגשנו בשני תיאורים ליסוד.
1. חומר שלא ניתן לפרקו לחומרים אחרים.
2. חומר הבנוי מסוג אחד של אטומים.
האם התיאורים הללו מסבירים זה את זה, או שהם סותרים זה את זה? נמקו את תשובתכם.
*189*
*189*
אנו כבר יודעים, כי היסודות בנויים מאטומים וכי האטום הוא החלקיק הקטן ביותר של היסוד. יש יסודות אל-מתכתיים המופיעים בטבע בחלקיקים הבנויים מאטומים בודדים, ויש יסודות אל-מתכתיים המופיעים בטבע בחלקיקים הבנויים משני אטומים, או יותר, הקשורים זה לזה. חלקיקים אלה נקראים מולקולות.
("אטומים קשורים" הם כאלה, שיש ביניהם כוחות משיכה מיוחדים. כל עוד הכוחות קיימים, הם גורמים לאטומים להיות סמוכים זה לזה. למשל, במולקולות דו-אטומיות.)
מולקולה של יסוד אל-מתכתי היא החלקיק הקטן ביותר של היסוד, כפי שהוא מופיע בטבע.
כל מולקולה של היסודות הליום, ניאון, ארגון ועוד בנויה מאטום בודד.
כל מולקולה של היסודות מימן, חמצן, חנקן ועוד בנויה משני אטומים הקשורים זה לזה. ואילו המולקולה של היסוד זרחן בנויה מ-4 אטומים של זרחן הקשורים זה לזה.
העתיקו את המשפטים הבאים למחברת והשלימו את החסר:
א. מולקולה של חמצן בנויה מ-- אטומים של חמצן. החלקיק הקטן ביותר של היסוד חמצן בנוי מ-- -- של חמצן.
ב. החלקיק הקטן ביותר של הליום בנוי מ-- -- של הליום.
*190*
*190*
לחומרים שונים יש תכונות שונות.
א. כאשר מערבבים חומרים שונים זה בזה, האם תכונותיהם נשמרות, או שנוצר חומר חדש בעל תכונות חדשותי
ב. ציינו מספר דוגמאות מחיי היומיום, שבהן מערבבים חומרים שונים זה בזה.
ג. האם, בדוגמאות שהבאתם, שמרו החומרים שבתערובת על תכונותיהם המקוריות? הסבירו.
תערובת מתקבלת על ידי ערבוב של חומרים שונים זה בזה. החומרים המעורבבים בתערובת אינם משנים את תכונותיהם.
א. בדקו את תכונות הגפרית והנחושת. היעזרו ברשימת התכונות המופיעה בטבלה הבאה.
התכונות | נחושת | גפרית | החומר שהתקבל בניסוי |
מה צבע החומר? | -- | -- | -- |
האם הוא מבריק?כן/לא | -- | -- | -- |
האם אפשר לכופף אותו?כן/לא | -- | -- | -- |
האם אפשר לפורר אותו ביד?כן/לא | --- | - | -- |
ב. העתיקו את הטבלה למחברת ורשמו בה, במקום המתאים, את תוצאות בדיקתכם.
*191*
א. הכניסו למבחנה 2-3 גרם גפרית (כפית) והוסיפו למבחנה פס דק של נחושת באורך 5-6 ס"מ. סתמו את פי המבחנה בפקק צמר גפן (ראו תצלום א').
(בספר שתי תמונות, היעזר במנחה)

החזיקו את המבחנה באטב וחממו אותה בלהבת גז (ראו תצלום ב').
שימו לב להתלהטות החומר ולשינויים שחלו בו. המתינו שהמבחנה תתקרר מעט. הוציאו את פקק צמר הגפן. הטו את פתח המבחנה כלפי מטה, והפס יחליק וייצא מהמבחנה.
בדקו את תכונות החומר החדש ורשמו אף אותן בטבלה.
ב. האם החומר שקיבלתם הוא נחושת? האם הוא גפרית? מנין אתם יודעים זאת?
בניסוי הזה נוצר חומר חדש. הנחושת והגפרית התרכבו, ונוצרה תרכובת הנקראת נחושת-גפרית. לתרכובת נחושת-גפרית יש תכונות השונות מתכונות הנחושת ומתכונות הגפרית.
ג. תארו את התהליך, שבו נוצר החומר נחושת-גפרית. העתיקו למחברת והשלימו:
-- + -- - חימום - -- (תרכובת)
התרכובת שהתקבלה היא חומר חדש. לתהליך שבו נוצר חומר חדש קוראים תהליך כימי.
*192*
ד. יש חומרים שמתרכבים, כאשר הם באים במגע. יש חומרים שלא יתרכבו, גם אם נחמם אותם. לדוגמה: נחושת וברזל. בחרנו בנחושת ובגפרית, כי שני יסודות אלה, בסיוע החימום, יכולים להתרכב זה עם זה.
1. באיזו מהפעולות הבאות התרחש תהליך כימי: (א) פירוק מים למימן וחמצן. (ב) יצירת מים ממימן ומחמצן. (ג) הרתחת מים.
2. העתיקו את הטבלה למחברת והשלימו בה את החסר.
תערובת | תרכובת |
א. החומרים שבה שומרים על כל תכונותיהם המקוריות. | -- |
ב. -- | נוצרת על-ידי התרכובת של חומרים שונים. |
ג. ניתן להבחין בחומרים השונים שבתערובת. | -- |
ד. -- | נוצר חומר חדש, בעל תכונות חדשות. |
ה. -- | קבלת תרכובת היא תהליך כימי. |
*192*
האוויר הוא תערובת של יסודות ותרכובות גזיים. כל אחד מהגזים המצויים באוויר שומר על תכונותיו. לדוגמה: אם נקרר את האוויר עד לטמפרטורה נמוכה מאוד, ישנה כל גז את מצב צבירתו בטמפרטורה האופיינית לו. הפחמן הדו חמצני יהפוך למוצק ב- -70 מעלות צלזיוס חמצן יהפוך לנוזל ב- -183 מעלות צלזיוס, וחנקן יהפוך למזל רק בטמפרטורה יותר נמוכה, ב- -196 מעלות צלזיוס.
הטבלה הבאה מסכמת את ההרכב המדויק של אוויר נקי יבש קרוב לפני הקרקע (הרכב האוויר שונה בגבהים שונים).
*193*
המרכיב | נפח |
חנקן | 78.08% |
חמצן | 20.94% |
ארגון | 0.92% |
פחמן דו חמצני | 0.03% |
ניאון | 0.002% |
(באוויר מצויות גם כמויות זעירות של הליום, קריפטון, כסנון ומימן.)
כמו בכל תערובת, הרכב האוויר אינו קבוע ואינו אחיד. הרכבו מושפע מהחומרים הנפלטים לתוכו. במקומות המצויים רחוק ממקום יישוב עירוני צפוף האוויר "נקי" יותר, ואילו באזורים שבהם מצויה תעשייה כבדה או ריבוי של כלי רכב, האוויר מכיל חומרים נוספים. חומרים אלה נפלטים לאוויר ממנועי מכוניות או מארובות המפעלים. לחלק מהחומרים האלה יש השפעה מזיקה על הבריאות. לכן שהייה ממושכת בכרךסואן עלולה לגרום לכאבי ראש ואף לסחרחורת.
א. לתופעה שבה תמיסה מימית של התרכובת נחושת כלורית מוליכה זרם חשמלי, ניתן באחת הכיתות ההסבר הבא:
"הולכת הזרם החשמלי על ידי התמיסה המימית של תרכובת זו נעשית, משום שהתמיסה מכילה את היסוד נחושת, ונחושת היא כידוע מוליך טוב.
לכן, התמיסה של נחושת כלורית במים מוליכה זרם חשמלי". האם ההסבר נכון? אם לא, מה שגוי בו?
ב. לפניכם רשימה של מספר פעולות או תופעות. ציינו לגבי כל אחת מהן אם היא נחשבת לתהליך כימי. נמקו את תשובותיכם.
1. סינון מים.
2. הכנת משקה "מיץ פטל".
3. הפרדת תמיסת מלח למים ולמלח.
4. שרפה בשדה קוצים.
5. חידוד עיפרון.
6. התעבות אדים על גבי החלון.
7. הופעת חלודה.
*194*
*194*
כאשר שני יסודות מתרכבים ויוצרים תרכובת, האטומים של יסוד אחד מתקשרים עם האטומים של יסוד שני.
(בספר תרשים, היעזר במנחה)
יסוד א (במצב גזי)+יסוד ב (במצב גזי) - תרכובת (במצב גזי)
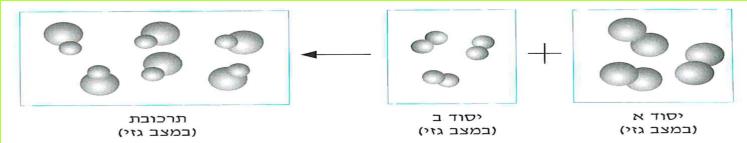
הקשר הנוצר בין האטומים נקרא קשר כימי. המשותף לכל המולקולות של התרכובות הוא היותן בנויות מאטומים של שני יסודות או יותר. לפניכם ארבעה תרשימים של מולקולות של תרכובות שונות. שימו לב, שכל מולקולה בנויה מאטומים של שני יסודות.
מולקולה של התרכובת פחמן דו-חמצני מורכבת מהאטומים של היסודות פחמן וחמצן. מולקולה של התרכובת מים מורכבת מהאטומים חמצן ומימן.
שם התרכובת | מבנה המולקולה(היעזר במנחה) |
פחמן דו חמצני | |
מים | |
מימן כלורי | |
פחמן ארבע כלורי |
*195*
א. מאילו אטומים בנויה המולקולה של התרכובת מימן כלורי?
ב. מאילו אטומים בנויה המולקולה של התרכובת פחמן ארבע כלורי?
יסוד - חומר הבנוי מאטומים זהים. (אטומים זהים הם אטומים בעלי אותו מספר אטומי, כלומר אטומים שיש להם אותו מספר פרוטונים בגרעין. לבן הם נחשבים לאטומים של אותו היסוד.)
תרכובת - חומר הבנוי מאטומים של יסודות שונים.
א. באילו מהתרשימים שלפניכם מתוארת תרכובת, באילו מהם מתואר יסוד, ובאילו מהם מתוארת תערובת? נמקו!
(בספר תשעה איורים, היעזר במנחה)
*196*
ב. אילו מהחומרים הבאים ניתנים לפירוק? ברזל, חמצן, סוכר, מימן, מים, נחושת, פחמן. נמקו!
ג. בניסויים שנעשו, פגשתם את החומרים הבאים: סוכר, מים, פחמן, נחושת כלורית, מימן, אבץ ברומי, כלור, ברום. מיינו במחברתכם את החומרים שברשימה זו לשתי קבוצות: לקבוצת היסודות ולקבוצת התרכובות.
ד. האם ניתן לפרק את הסוכר ליסודותיו על ידי פעולת חימום בלבד? הסבירו את תשובתכם!
ה. לפניכם רשימת פעולות שנעשו בחומרים שונים. באילו מהמקרים הבאים לא גרמה הפעולה לפירוק החומר? נמקו!
1. שבירת קרח בפטיש.
2. זיקוק מים. (זיקוק = הפרדה בין חומרים השונים זה מזה בנקודת הרתיחה שלהם.)
3. חימום קרח.
4. אלקטרוליזה של נחושת כלורית.
5. פירור גוש נחושת לגרגרי נחושת זעירים.
6. סינון מים. (סינון = הפרדה בין נוזל לבין חומרים אחרים המצויים בו, על פי גודל החלקיקים.)
ו. בעבר הרחוק סברו הכימאים, כי המים הינם יסוד. הסברה התבססה על אי הצלחתם לפרק את המים, למרות כל ניסיונותיהם. כיום ידוע לכולנו, כי המים אינם יסוד אלא חומר מורכב, כלומר, ניתן לפרקם לחומרים אחרים. מדוע נכשלו הכימאים בניסיונותיהם לפרק את המים?
בקטעים הבאים מוסברים המושגים: אטום, מולקולה, תרכובת ותערובת. שבצו מושגים אלה במקומות המתאימים. העתיקו את הקטעים למחברתכם והשלימו אותם.
ז. יסוד הוא חומר שאי אפשר לפרקו לחומרים אחרים. החלק הקטן ביותר של יסוד הוא ה --. איש לא ראה מעולם -- כלשהו בעיניו; הוא קטן מדי. אך ניסויים ומדידות מדויקים בסיוע חשיבה מזהירה של מספר חוקרים, יחד עם חישובים מתמטיים מורכבים, נתנו למדע מושג טוב למדי על מבנה ה--: גרעין זעיר בנפחו ואלקטרונים הנעים בהתמדה.
*197*
ח. מכל מקום, -- קשורים ביניהם. רק לעתים רחוקות הם אינם קשורים זה עם זה. הם מתקשרים באמצעות כוחות חשמליים, לפעמים עם -- זהים ולפעמים עם -- של יסודות אחרים. -- של חמצן, לדוגמא, יכול להתחבר עם -- אחר של חמצן תוך יצירת -- מולקולה של חמצן. אך אם -- החמצן מתחבר עם יסוד אחר, נוצרת -- של תרכובת. מים הם -- כזאת, הנוצרת בהתחברות -- אחד של חמצן (O) עם שני -- של מימן (H).
ט. אחד מהמאפיינים של ה-- הוא שיש לה תכונות, שאינן קיימות ביסודות המרכיבים אותה. המים, לדוגמה, מורכבים משני יסודות. אחד מהם, מימן, הוא גז דליק; השני, חמצן, הוא גז החיוני לבערה. אף על פי כן המים עצמם הם נוזל, שאיננו דליק ואינו מסייע לבערה. המים הם דוגמה אחת, אבל לאמיתו של דבר קיימות מיליונים של --, המהוות את עיקרו של החומר בעולם.
י. בתערובות, כמו ב--, יש שניים או יותר סוגים של אטומים. אלא שבתוך ה--, שלא כמו ב--, אין ה-- של החומרים השונים מחוברים זה לזה בקשר כימי. כל חומר בתערובת שומר כאן על זהותו ועל תכונותיו. אפשר להפריד בין החומרים על ידי שימוש באמצעים לא כימיים (כמו סינון, זיקוק והרתחה). חלק מהמזון שאנו אוכלים, חלק מהבדים בהם אנו משתמשים, האוויר שאנו נושמים - כל אלה הם --. האוויר, לדוגמא, מורכב בעיקר מחמצן ומחנקן. אולם, כל אחד מן הגזים שומר על תכונותיו העצמיות, ובאמצעות ציוד מתאים אפשר להפרידו מן ה--.
יא. בפירוק סוכר קיימים שני שלבים. בשלב הראשון של הפירוק מקבלים מים ופחמן. בחרו את המשפט הנכון.
1. הסוכר מורכב ממים ומפחמן.
2. אם נוסיף פחמן למים נקבל סוכר.
3. הסוכר מורכב מאטומים של פחמן ומאטומים של מים.
4. הסוכר מורכב מאטומים של פחמן, אטומים של מימן ואטומים של חמצן.
*198*
- יסוד הוא חומר הבנוי מאטומים זהים.
- יסודות שונים בנויים מאטומים שונים.
*198*
היסודות הם חומרים, שמהם בנויים כל החומרים המוכרים לאדם.
עד כה נתגלו 92 יסודות הקיימים בטבע. לכל יסוד ויסוד יש שם משלו.
שם היסוד בעברית | שם היסוד באנגלית |
מימן | Hydrogen |
גפרית | Sulfur |
חמצן | Oxygen |
חנקן | Nitrogen |
יוד | Iodine |
כדי להקל בכתיבת שמות היסודות נוהגים לכתוב רק את קיצור השם באנגלית. קיצור השם באנגלית נקרא הסימן הכימי של היסוד. בסימן הכימי כלולה תמיד האות הראשונה של השם באנגלית.
שם בעברית | הסימן הכימי | השם באנגלית |
מימן | H | Hydrogen |
גפרית | S | Sulfur |
חמצן | O | Oxygen |
חנקן | N | Nitrogen |
יוד | I | Iodine |
*199*
מכיוון שישנם יסודות ששמם מתחיל באותה האות, לדוגמה Hydrogen ו-Helium לא נוכל להשתמש באות H כסימן כימי לשניהם. לכן הוחלט להשתמש במקרים כאלה בסימן כימי בעל שתי אותיות. יש לשים לב, כי בסימנו הכימי של היסוד המורכב משתי אותיות תהיה רק האות הראשונה אות גדולה.
שם בעברית | הסימן הכימי | השם באנגלית |
הליום | He | Helium |
כלור | Cl | Chlorine |
סידן | Ca | Calcium |
ניאון | Ne | Neon |
השם בעברית | המספר אטומי | הסימן הכימי | השם באנגלית |
מימן | 1 | H | Hydrogen |
הליום | 2 | He | Helium |
ליתיום | 3 | Li | Lithium |
בריליום | 4 | Be | Beryllium |
בור | 5 | B | Boron |
פחמן | 6 | C | Carbon |
חנקן | 7 | N | Nitrogen |
חמצן | 8 | O | Oxygen |
פלואור | 9 | F | Fluorine |
ניאון | 10 | Ne | Neon |
נתרן | 11 | Na | Sodium |
את הרשימה המלאה של היסודות תמצאו בעמודים האחרונים של הספר. מופיעים בה כל היסודות בשמותיהם העבריים מסודרים לפי הא"ב. כל יסוד מופיע גם בסימנו הכימי ובשמו בשפה האנגלית.
*200*
*200*
רוב היסודות התגלו ב-250 השנים האחרונות, עם התפתחות הכימיה המודרנית. למרבית היסודות שנתגלו בשנים אלה, ניתנו שמות שמקורם בשפה הלטינית או היוונית. הסימן הכימי הוא קיצור של השם הזה.
גם ליסודות המוכרים עוד מהעת העתיקה כמו זהב וכסף ניתנו הסימנים לפי שמותיהם בשפה הלטינית, Au ו- Ag, אבל בכל שפה יש למתכות אלה שמות אופייניים משלהם. למשל, ברזל נקרא באנגלית IRON. בלטינית נקרא הברזל FERRUM. מכאן גם הסימן הכימי Fe של היסוד ברזל.
לפניכם מספר יסודות מוכרים, שסימנם הכימי מקורו בשם הלטיני ולא בשם האנגלי.
השם העברי | השם האנגלי | השם הלטיני | הסימן |
ברזל | Iron | Ferrum | Fe |
כסף | Silver | Argentum | Ag |
זהב | Gold | Aurum | Au |
עופרת | Lead | Plumbum | Pb |
נתרן | Sodium | Natrium | Na |
אשלגן | Potassium | Kalium | K |
כספית | Mercury | Hydrargyrum | Hg |
ברשימת השמות באנגלית שבסוף הספר, מופיעים שמות לטיניים ויווניים, שהשפה האנגלית אימצה והפכה לחלק ממנה.
א. אף שאנשי מדע מארצות שונות דוברים שפות שונות, נוהגים בעולם כולו להשתמש באותם הסימנים הכימיים של היסודות. האם יש לכך יתרון? ואם כן, מהו?
ב. השלימו והסבירו את התרשים הבא:
- כלל החומרים בעולם - -- - יסודות
- כלל החומרים בעולם – יסודות
*201*
ג. העתיקו למחברת את שלושת התרשימים והשלימו בהם את החסר. היעזרו ברשימת היסודות המובאת בעמודים 297-299.
(היעזר במנחה)
1. פירוק מים:
מים: פירוק:
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
מים: פירוק:
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
2. פירוק נחושת כלורית:
נחושת כלורית: פירוק:
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
3. פירוק סוכר:
סוכר: פירוק: --
סוכר: פירוק: --
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
סוכר: פירוק: --
שם היסוד: --
סימנו הכימי: --
מספרו האטומי: --
*202*
כאשר בונים כלי או מכשיר, המתכננים בוחרים חומרים בעלי תכונות מתאימות, שיאפשרו לכלי למלא את יעודו בצורה הטובה ביותר.
נורת הליבון, או בשמה האחר נורת להט, תשמש לנו דוגמה לעניין זה.
לפניכם מונחת נורת להט רגילה. הנורה מוכרת לכם מלימודיכם הקודמים. על כן נוכל לגשת מיד להדגמה.
(בספר תמונה, היעזר במנחה)
א. נבריג את הנורה לתוך בית הנורה, נסגור את המעגל החשמלי, הנורה מאירה. נמתין שניות אחדות.
ב. נחליף את הנורה בנורה אחרת, שהסרנו ממנה את מעטפת הזכוכית.
התבוננו היטב בנורה ברגע, שבו נסגור את המעגל החשמלי.
מה קרה? תארו את אשר התרחש!
כאשר זרם חשמלי עובר בחוט להט, חוט הלהט מתחמם עד כדי התלהטות הגורמת להפצת אור.
מלימודיכם אתם יודעים, כי החמצן הוא יסוד שמסייע לבערה. חוט הלהט עשוי מיסוד מתכתי בשם טונגסטן. כמו כל מתכת אחרת, כשטונגסטן לוהט הוא עלול לבעור בנוכחות חמצן. לכן אין להשאיר חמצן בקרבת חוט הלהט, כי במצב כזה נצטרך להחליף נורה מדי מספר דקות.
כיצד התגברו יצרני הנורות על בעיה זו? ראשית, הוציאו את החמצן מתוך הנורה. זאת הם עשו על ידי שאיבת האוויר מתוכה. במקום האוויר שנשאב מוכנס גז, שאינו מסייע לבערה, כגון היסודות הגזיים חנקן וארגון. ודאי תשאלו: מדוע צריך להכניס לחלל הנורה גז אחר, במקום האוויר שהוציאו מתוכה? הסיבה לכך נעוצה בעובדה שבתנאי ריק ובטמפרטורה גבוהה כמו זו הקיימת בנורה, חוט הלהט מתאדה די מהר. אטומים הבונים את חוט הלהט ניתקים ממנו ועוברים לריק שמסביב, ולבסוף נוחתים על דופן הזכוכית. כתוצאה מכך משחירה הזכוכית וחוט הלהט הופך דק יותר. כך הוא נקרע ביתר קלות. נוכחותו של גז בחלל הנורה מקטינה ומאיטה את השינויים הנגרמים בחוט הלהט, ובכך מאריכים את משך "חיי הנורה".
אך בכך לא תמו הקשיים בפיתוח הנורה. התיל מתלהט בעת מעבר החשמל בתוכו, לכן הוא חייב להיות עמיד בטמפרטורות גבוהות, כ-1000 מעלות צלזיוס, כדי לא להינתך.
מפתחי הנורה היו צריכים למצוא חומר המוליך חשמל, אבל בעל נקודת היתוך גבוהה.
*203*
בטבלה הבאה ניתנת רשימה של יסודות מתכתיים וטמפרטורת ההיתוך האופיינית לכל אחד מהם.
(טמפרטורת היתוך = הטמפרטורה שבה הופך מוצק לנוזל)
היסוד | סימנו | טמפרטורת ההיתוך (מעלות צלזיוס) |
אלומיניום | Al | 660 |
בדיל | Sn | 232 |
ברזל | Fe | 1535 |
טונגסטן | W | 3410 |
נחושת | Cu | 1083 |
א. מדוע, לדעתכם, נבחר דווקא הטונגסטן כחומר להכנת חוט הלהט?
ב. התבוננו בתרשים הנורה. מופיעים בו חלקי הנורה, ומצוין לידם שם החומר, שממנו הם עשויים. הסבירו מדוע משתמשים דווקא בחומרים אלה. את תשובותיכם ערכו בעזרת הטבלה שבעמוד הבא.
(בספר איור, היעזר במנחה)
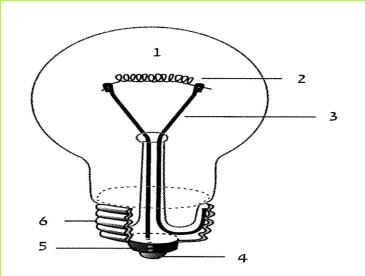
1. חלל אגס הזכוכית מכיל גז שלא מסייע לבערה
2. חוט להט - עשוי מטונגסטן
3. חוט נחושת עבה באופן יחסי
4. נקודת בסיס עשויה עופרת
5. חומר מבדד
6. תבריג ממתכת
*204*
חלק הנורה | תפקיד החלק | היסוד ממנו עשוי החלק | תכונות היסוד המתאימות למילוי תפקידו של החלק |
חומר מילוי בחלל הנורה | 1. למנוע את בערת חוט הלהט2. להקטין את קצב ההתאדות של חוט הטונגסטן. | ארגון (Ar) | 1. אינו מאפשר בערה.2. שקוף ומאפשר את מעבר האור לסביבה. |
חוט להט | -- | טונגסטן (W) | -- |
בסיס הנורה | -- | עופרת (Pb) | -- |
תבריג הנורה | -- | נחושת (Cu) | -- |
חוט מוליך בין בסיס הנורה לבין התבריג | -- | נחושת (Cu) | -- |
א. האוויר הוא תערובת של גזים. למרות מצב הצבירה הגזי אין הוא מתאים למילוי הנורה. מדוע?
ב. האם כדאי להכין חוט להט מכל מתכת? נמקו!
ג. מדוע יש צורך במיכל הזכוכית בנורה?
ד. מדוע יש צורך במילוי הנורה בגז ארגון? האם לא היה פשוט יותר להשאירה ריקה?
נא להכיר "משפחה כימית", ראו עמודים 211-213.
*205*
- בטבע מצויים 92 יסודות.
- היסודות שונים זה מזה בתכונותיהם.
- ישנם יסודות שלהם מספר תכונות דומות.
- לקבוצה של יסודות הדומים מאוד בתכונותיהם אנו קוראים משפחה כימית.
הדמיון שנתגלה בתכונות אחדות של יסודות שונים הביא את הכימאים לחפש דרך לסדר את כל היסודות, ולמיינם לקבוצות המבליטות את התכונות המשותפות ליסודות שבכל קבוצה.
מן הראוי לציין, שהראשון שערך את היסודות על פי תכונותיהם בטבלה שימושית היה הכימאי הרוסי הדגול דימיטרי מנדלייב. לכן, יש הקוראים לטבלה המחזורית בשם "טבלת מנדלייב". טבלתו של מנדלייב פורסמה לראשונה בשנת 1869. בטבלתו שובצו 63 יסודות. בשנים שלאחר מכן נתגלו יסודות נוספים, ומספרם כיום הוא 107. 92 מהם מצויים בטבע. האחרים הינם יסודות שהופקו באופן מלאכותי בכורים גרעיניים.
לאחר מחקרים מעמיקים הגיעו למסקנה, שאפשר לסדר את כל היסודות בטבלה על פי שתי אמות מידה:
א. לפי המספר האטומי של היסוד, כלומר, מספר הפרוטונים שבאטום היסוד.
ב. לפי תכונות משותפות לקבוצות של יסודות.
שימו לב: טבלת היסודות מופיעה בעמוד הבא.
מעיון בטבלת היסודות אנו רואים, כי היסודות ערוכים בשורות ובטורים. היסודות הערוכים בשורות מסודרים לפי מספר אטומי, ההולך ועולה משמאל לימין. היסודות הערוכים בטורים ערוכים לפי תכונות משותפות. נבחן שני טורים כאלה.
טור מס' 1. בטור זה מקובצים כל היסודות המהווים את משפחת המתכות האלקליות. (המימן אינו שייך לקבוצה זו).
טור מס' 8. בטור זה מקובצים כל היסודות המהווים את משפחת הגזים "האצילים".
*206*
*206*
1 - H - מימן | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 2 - He - הליום |
3 - Li - ליתיום | 4 - Be - בריליום | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 5 - B - בור | 6 - C - פחמן | 7 - N - חנקן | 8 - O - חמצן | 9 - F - פלואור | 10 - Ne - ניאון |
11 - Na - נתרן | 12 - Mg - מגנזיום | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 13 - Al - אלומניום | 14 - Si - צורן | 15 - P - זרחן | 16 - S - גופרית | 17 - Cl - כלור | 18 - Ar - ארגון |
19 - K - אשלגן | 20 - Ca - סידן | 21 - Sc - סקנדיום | 22 - Ti - טיטניום | 23 - V - ונדיום | 24 - Cr - כרום | 25 - Mn - מנגן | 26 - Fe - ברזל | 27 - Co - קובלט | 28 - Ni - ניקל | 29 - Cu - נחושת | 30 - Zn - אבץ | 31 - Ga - גאליום | 32 - Ge - גרמניום | 33 - As - ארסן | 34 - Se - סלניום | 35 - Br - ברום | 36 - Kr - קריפטון |
37 - Rb - רובידיום | 38 - Sr - סטרונציום | 39 - Y - איטיריום | 40 - Zr - זירקוניום | 41 - Nb - ניאוביום | 42 - Mo - מולבידן | 43 - Tc - טכנציום | 44 - Ru - רותיניום | 45 - Rh - רודיום | 46 - Pd - פלדיום | 47 - Ag - כסף | 48 - Cd - קדמיום | 49 - In - אינדיום | 50 - Sn - בדיל | 51 - Sb - אנטימון | 52 - Te - טלור | 53 - I - יוד | 54 - Xe - קסנון |
55 - Cs - צזיום | 56 - Ba - באריום | 57-71 - ראה - למטה | 72 - Hf - הפניום | 73 - Ta - טנטליום | 74 - W - טונגסטן | 75 - Re - רניום | 76 - Os - אוסמיום | 77 - Ir - אירידיום | 78 - Pt - פלטינה | 79 - Au - זהב | 80 - Hg - כספית | 81 - Tl - תליום | 82 - Pb - עופרת | 83 - Bi - ביסמוט | 84 - Po - פולניום | 85 - At - אסטטין | 86 - Rn - ראדון |
87 - Fr - פרנציום | 88 - Ra - רדיום | 89-103 - ראה - למטה | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק |
תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק |
תא ריק | תא ריק | 57 - La - לנתן | 58 - Ce - צריום | 59 - Pr - פרסאודימיום | 60 - Nd - ניאודמיום | 61 - Pm - פרומתיום | 62 - Sm - סמריום | 63 - Eu - אירופיום | 64 - Gd גדוליניום | 65 - Tb - טרביום | 66 - Dy - דיספרוסיום | 67 - Ho - הולמיום | 68 - Er - ארביום | 69 - Tm - תולום | 70 - Yb - איטרביום | 71 - Lu - לוטציום | תא ריק |
תא ריק | תא ריק | 89 - Ac - אקטיניום | 90 - Th - תוריום | 91 - Pa - פרואקטיניום | 92 - U - אורניום | 93 - Np - נפטוניום | 94 - Pu - פלוטוניום | 95 - Am - אמרציום | 96 - Cm - קיוריום | 97 - Bk - ברקליום | 98 - Cf - קליפורניום | 99 - Es - אנשטיניום | 100 - Fm - פרמיום | 101 - Md - מנדלביום | 102 - No - נובליום | 103 - Lr - לורנציום) | תא ריק |
הערה: הטבלה אינה שלמה. כיום ידועים 107 יסודות.
*207*
נוסף לחלוקה למשפחות כימיות, הערוכות בטורים, ניתן לראות, שהיסודות ערוכים גם בגושים גדולים יותר: גוש המתכות וגוש האל-מתכות.
נוכל להציג חלוקה זו של יסודות בהתאם למידת הדמיון בין תכונותיהם, בדרך הבאה:
(בספר תרשים, היעזר במנחה)
לטבלת היסודות תרומה חשובה לעבודת הכימאי. בעזרתה הוא יכול לדלות מידע על התכונות ועל ההתנהגות של היסודות, שבהם הוא מעוניין.
הבה ננסה גם אנו לראות, כיצד תוכל הטבלה לסייע לנו ללמוד על יסודות אחדים.
א. מצאו את מקומו של היסוד שמספרו האטומי הוא 29.
1. מהו סמל היסוד? (סימנו הכימי).
2. האם לדעתכם הוא מוליך זרם חשמלי?
3. האם לדעתכם יש לו ברק מתכתי?
4. האם לדעתכם הוא ניתן לריקוע?
ב. מצאו את מקומו של היסוד, שמספרו האטומי הוא 8.
1. מהו סמל היסוד? (סימנו הכימי).
2. האם הוא מוליך חשמל?
מאחר שאנו רק בראשית לימודי הכימיה, לא יכולנו להרחיב את הלימוד על תכונות ומאפיינים נוספים של היסודות. כשתלמדו להכיר את הטבלה בצורה מפורטת תוכלו לעמוד על מידת המידע הרב שניתן לדלות ממנה.
*208*
*208*
משפחת ההלוגנים מופיעה בטבלת היסודות בטור הסמוך לגזים ה"אצילים". הגזים האצילים נקראים כך, משום שאינם נוטים להגיב עם חומרים אחרים, כלומר הם בעלי פעילות כימית נמוכה. בניגוד לשכניהם האצילים היסודות ההלוגניים הם בעלי פעילות כימית גדולה מאוד. בגלל תכונה זו אין מוצאים אותם בטבע כיסודות חופשיים, אלא כתרכובות.
חלק מהתרכובות של ההלוגנים נקראות "מלחים", ורבות מהן מומסות במי ים. במשפחת ההלוגנים מספר יסודות, ולהם שימושים רבים:
הפלואור (סמלו הכימי F) הוא גז צהבהב פעיל מאוד, רעיל ומסוכן. אולם מלחים של פלואור משמשים להגנה בפני עששת. לצורך זה יש המוסיפים למשחות שיניים מלח של פלואור, "פלואוריד". רשויות מקומיות אחדות נוהגות להוסיף תרכובות של פלואור למי השתייה, כאמצעי הגנה מפני עששת. תרכובות פלואור משמשות גם כגזי דחף בתרסיסים למיניהם.
הכלור (סמלו הכימי Cl) הוא גז ירקרק רעיל מאוד, שהיה לאמצעי הלחימה הכימי הראשון במלחמת העולם הראשונה. בתמיסה במים מי כלור מוכרים לנו כחומר חיטוי בבריכות שחייה. התרכובת המוכרת ביותר היא, כמובן, מלח הבישול (NaCl).
הברום (סמלו הכימי Br) הוא נוזל אדום-חום נדיף מאוד וכבד. אדיו צורבים ומסוכנים. הברום משמש להכנת צבעים, חומרי צילום, תרופות ובגדים חסיני אש. תרכובות הברום נמצאות בכמויות גדולות במי ים המלח. מדינת ישראל היא היצואן השני בעולם של ברום ותרכובותיו. אחת מהתרכובות המשווקות היא מתיל ברומי. אותו מוסיפים לדלק מטוסים. יש הסבורים שתרכובת זו גורמת לפגיעה בשכבת האוזון ועל כן מהווה בעיה לאיכות הסביבה.
היוד (סמלו הכימי I) הוא יסוד מוצק בעל צבע כהה הממריא בקלות - בחימום קל הוא עובר ישר ממצב צבירה מוצק למצב צבירה גז שצבעו סגול.
תמיסת יוד בכוהל שצבעה חום מוכרת לנו ממדף התרופות כחומר לחיטוי פצעים. תרכובות היוד מצויות בגופנו בכמויות זעירות. כמויות זעירות אלו חשובות מאוד להתפתחות תקינה של הגוף.
היוד גם מאריך את "חייהן" של נורות חשמל. על כך תוכלו לקרוא בקטע הבא.
נורת ההלוגן הינה נורת ליבון בעלת ממדים קטנים משל נורת ליבון רגילה. הנורה עשויה מזכוכית מיוחדת - זכוכית קוורץ העמידה בטמפרטורות גבוהות. לגז הממלא את חלל הנורה מכניסים תוספת קטנה של אדי יוד. אדי היוד מאריכים את משך "חייו" של חוט הלהט. הכיצד? אדי היוד מתרכבים עם הטונגסטן, שהצטבר על דפנות הזכוכית, ונוצרות מולקולות של התרכובת טונגסטן יודי. מולקולות אלו נמצאות בחלל הנורה במצב של גז ונעות בתוכו בחופשיות. כאשר הן פוגעות בחוט הלהט, הנמצא בטמפרטורה יותר גבוהה, מתפרקות המולקולות
*209*
לאטומים של טונגסטן ולאטומים של יוד. אטומי הטונגסטן מצטרפים שוב לחוט הלהט והופכים לחלק ממנו. בדרך זו נמנע המצב, שבו חוט הלהט הולך ונעשה דק יותר עד הוא נקרע. התהליך חוזר על עצמו. אטומי היוד, שהשתחררו מהתרכובת טונגסטן יודי, מתפזרים שוב בחלל הנורה ומתרכבים שוב עם אטומי טונגסטן, שהתאדו מחוט הלהט. בדרך זו נמנעת הצטברות אבקת מתכת הטונגסטן השחורה על דפנות המיכל.
היוד הוא יסוד אל מתכתי ממשפחת ההלוגנים. הנוכחות של יסוד ממשפחה זו בנורה הקנתה לנורה את שמה - נורת הלוגן.
*209*
ב-1783 הצליחו האחים הצרפתים מונגולפיה להפריח בפעם הראשונה כדור פורח. עקרונו של הכדור הפורח פשוט מאוד. בלון גדול, עשוי מחומר "קל", ממולא בגז שהוא "קל" מהאוויר, וכתוצאה מכך הכדור מתרומם אל-על.
הכדורים הראשונים הוצבו מעל מדורה גדולה והתמלאו באוויר חם. מכיוון שאוויר חם קל מאוויר קר, התרומם הכדור מעלה. לבלון היה מחובר סל לנוסעים. הם נהגו לקחת איתם בתוך הסל חבילות קש, שאותו הבעירו כדי לחמם את האוויר בתוך הכדור. כשכיבו את האש, האוויר התקרר והכדור ירד.

*210*
בשנת 1785 הגה פיסיקאי צרפתי, בשם שרל, את הרעיון להחליף את האוויר החם בגז מימן. גז המימן הוא הגז הקל ביותר, ולכן אין צורך לחממו על מנת שהכדור יתרומם. כשהנוסעים רצו לרדת, נהגו לשחרר חלק מהגז. כך הצליח שרל לחצות לראשונה את תעלת לה מאנש, התעלה המפרידה בין צרפת לאנגליה. ניסיון לחזור על המבצע הסתיים באסון. הגז שבכדור התלקח, והנוסעים ניספו. מתכנני כדור זה לא הביאו בחשבון תכונה נוספת של המימן, שעליה למדת בפרק זה - המימן הוא גז דליק מאוד. הניצוץ הקטן ביותר הופך את תערובת המימן עם חמצן האוויר לתערובת דליקה. אסונות מהסוג שהזכרנו כאן הביאו להחלטה לא להשתמש בגז המימן למילוי ספינות אוויר וכדורים פורחים, ונוצר הצורך למצוא גז אחר. תחליף אידיאלי למימן הוא גז ההליום. ההליום הוא הגז הקל ביותר, פרט למימן. השתייכותו למשפחת הגזים האצילים הופכת אותו לבלתי פעיל, ובתור שכזה אין השימוש בו מסוכן. לכן החליף את המימן במילוי כדורים פורחים.
כידוע, חשיבותם של חומרים קשורה, בדרך כלל, בפעילות הכימית שלהם, כלומר, באילו תגובות כימיות הם מסוגלים להגיב. כאן ראינו כי לגזים האצילים יש שימושים, המבוססים דווקא על חוסר הפעילות שלהם.
(בספר תמונה, היעזר במנחה)

*211*
*211*
בשיעור האחרון בחנו את תכונותיהם של היסודות:
נחושת, עופרת, טונגסטן וארגון. ראינו כיצד תכונותיהם האופייניות מנוצלות בנורה החשמלית.
ליסודות המתכתיים שהזכרנו - נחושת, עופרת וטונגסטן, יש מספר תכונות משותפות כמו: מוליכות חשמלית, הולכת חום, ברק מתכתי, מוצקות בטמפרטורת החדר ובערה בחמצן בטמפרטורה גבוהה.
(טמפרטורת החדר = לטמפרטורה שבין 15 ל-25 מעלות צלסיוס נוהגים לקרוא "טמפרטורת החדר".)
לעומתם ניחן הארגון בתכונות אחרות לגמרי. הוא אינו מוליך חשמל, אינו מוליך חום, חסר ברק, גז בטמפרטורת החדר, אינו בוער בחמצן וחסר צבע.
מהשוואה זו רואים, כי ישנם הבדלים ניכרים בין תכונות הארגון לתכונות הנחושת, העופרת והטונגסטן. האם יש יסוד או יסודות נוספים הדומים בתכונותיהם לארגון?
שאלה זו נשאלה גם בבית חרושת לנורות. בבית חרושת זה אזל מלאי הארגון. האם יאלץ בית החרושת להפסיק את הייצור? אם יימצא חומר שדומה בתכונותיו לארגון, הוא יוכל להחליף את הארגון בנורה החשמלית, ובית החרושת יוכל להמשיך לייצר נורות.
בדיקת התכונות של היסודות האחרים מלמדת, כי קיימת קבוצה של יסודות שלהם תכונות דומות לאילו של הארגון. כולם מתאימים לשמש כחומר מילוי בנורות חשמל. על קבוצה זו נמנים היסודות:
הליום He
ניאון Ne
ארגון Ar
קריפטון Kr
כסנון Xe
בשל תכונותיהם הדומות, ניתן לראות את חמשת היסודות כנמנים עם אותה "משפחה כימית". משפחה כימית זו מכונה בשם גזים "אצילים". שם זה ניתן למשפחה על שום תכונותיה האופייניות. השם גזים בא ללמדנו כי אלה גזים
*212*
בטמפרטורת החדר, והשם "אצילים" בא להעיד על אופי התנהגותם בהשוואה ליסודות האחרים. בדרך כלל הם אינם מתרכבים עם יסודות אחרים, אלא נשארים כפי שהם. בתנאי מעבדה מיוחדים הצליחו ליצור מהם תרכובות עם יסודות אחרים.
הארגון היה הגז האציל הראשון שנתגלה. מקור השם ארגון הוא מהמילה היוונית "עצלן". האם תוכלו להסביר, מדוע כונה הארגון בשם זה?
תכונה זו - אדישותם הכימית כלפי יסודות וחומרים אחרים - הקנתה להם חשיבות רבה. בעבודה ל"ו בעמוד 202 ראינו זאת ביחס ליסוד ארגון. ליסוד הליום תכונה חשובה נוספת ועל כן השתמשו בו בנשיאתן של "ספינות אוויר". על כך תוכלו לקרוא בקטע: המימן, ההליום וכדורים פורחים בעמ' 209.
נוסף למשפחת הגזים האצילים קיימות משפחות כימיות, כמו משפחת המתכות האלקליות. עם משפחה זו נמנים היסודות:
Li ליתיום
Na נתרן
K אשלגן
Rb רובידיום
Cs צסיום
Fr פרנציום
המאפיין קבוצה זו של יסודות הוא המהירות הרבה, שבה הם מתרכבים עם יסודות אל-מתכתיים ועם מים. את מידת הדמיון בתכונותיהם נוכל לראות בעזרת שני יסודות ממשפחה זו. היסודות האחרים ברשימה אינם בהישג יד של המורה.
מתוך כלי האחסנה ניקח גוש קטן של חומר מהיסודות נתרן ואשלגן. נבחן את תכונותיהם של היסודות הללו בהתאם לרשום בטבלה הבאה:
א. העתיקו את הטבלה והשלימו אותה לפי הבדיקות.
שם היסוד | סמל כימי | מצב צבירה בטמפרטורת החדר | קשיות | ברק מתכתי | מוליכות חשמלית | תגובה עם מים | האם נוצר חומר חדש? |
נתרן | -- | -- | -- | -- | -- | -- | -- |
אשלגן | -- | -- | -- | -- | -- | -- | -- |
*213*
תחילה נתבונן בגוש החומר של כל אחד משני היסודות המופיעים בטבלה. צבעם כהה במקצת ועמום.
ב. באיזה מצב צבירה מצויים החומרים?
ניקח סכין ונבדוק, אם ניתן לחתוך את גושי החומר.
ג. התבוננו היטב! האם נדרש מאמץ רב לחותכן? האם פיסות החומר הן רכות או קשות ביחס למתכות אחרות?
ד. נתבונן במידת הברק באזור החתך. האם הופיע ברק מתכתי או מראה עמום?
ה. ננסה עתה לבדוק את מידת הולכתן החשמלית, בעזרת מעגל חשמלי שהכנו מראש. האם שני היסודות מוליכים זרם?
עכשיו נבדוק את תגובת היסודות האלה עם מים. לפנינו שתי כוסות מים.
נניח בזהירות בכוס אחת פיסה קטנה של נתרן ונצפה במתרחש.
נכניס פיסת אשלגן לכוס השנייה. צפו בתגובה!
(בספר תמונה, היעזר במנחה)

א. תארו את תגובת שני היסודות עם המים!
ב. למי מהם תגובה חזקה יותר עם המים? נמקו!
בגלל פעילותם הכימית הרבה לא נהוג לאכסן נתרן ואשלגן בכלים פתוחים או במים, מחשש להתלקחות. על כן מאכסנים אותם בכלים עם שמן או נפט. אין הם מגיבים עם שמן או נפט.
לאחר שפרסנו חתיכה של חומר מפיסות שני היסודות שהזכרנו, הבחנו, כי לשניהם יש ברק מתכתי. אך עם הזמן הברק הולך ומתעמעמם, והשינוי במידת הברק של יסודות ממשפחה זו הינו מאפיין נוסף שלהם.
אטומי החמצן, שמהם בנויות מולקולות החמצן שבאוויר, מתקשרים לאטומים של יסודות אלה, המצויים בשטח הפנים של אזור החתך. בהתרכבות עם החמצן אובד הברק המתכתי.
תגובה זו עם החמצן הינה עדות נוספת למידת פעילותם הכימית הרבה.
לקבוצה של יסודות הדומים מאוד בתכונותיהם אנו קוראים בשם "משפחה כימית".
*214*
*214*
אלקטרוליזה היא תהליך כימי, המתרחש בחומר מותך או מומס על ידי העברת זרם חשמלי. התהליך מתרחש על האלקטרודות, בשטח המגע בין האלקטרודות והתמיסה.
לאלקטרוליזה תפקיד מרכזי בשני תהליכים בעלי חשיבות תעשייתית:
א. הפקת יסודות.
ב. ציפויים מתכתיים.
אפשר להפיק יסודות שונים בתעשייה על ידי אלקטרוליזה. אלקטרוליזה של נתרן כלורי מותך היא אחת השיטות התעשייתיות להפקת המתכת נתרן. אל האלקטרודה השלילית נמשכים יוני הנתרן Na^+. כל אחד מיוני הנתרן לוקח מהאלקטרודה השלילית אלקטרון ונוצר נתרן מוצק.
אל האלקטרודה החיובית נמשכים יוני הכלור השליליים. האלקטרודה החיובית לוקחת מכל אחד מהם את האלקטרון העודף והופכת אותם לכלור חופשי.
(בספר איור, היעזר במנחה)
אחד השימושים המעניינים במתכת נתרן הוא כנוזל קירור. בכורים גרעיניים מים אינם יכולים לשמש כנוזל קירור, כי כורים גרעיניים פועלים בטמפרטורה של כ-600 מעלות צלזיוס.
את המתכת אלומיניום מפיקים גם על ידי אלקטרוליזה של תחמוצת אלומיניום מותכת (Al[2]O[3]). לקבלת 1 טון אלומיניום דרושים 1.9 טון תחמוצת של אלומיניום.
*215*
כמו כן אפשר להפיק יסודות על ידי אלקטרוליזה של תמיסות מימיות של מלחים (מלחים שהומסו במים). במפעל ים המלח, למשל, מפיקים את הכלור על ידי אלקטרוליזה של תמיסה מרוכזת של נתרן כלורי (NaCl).
בציפוי אלקטרוליטי, שהוא תהליך אלקטרוליזה לכל דבר, עשויה האלקטרודה השלילית מהחפץ שאותו יש לצפות. במהלך הציפוי מתכסה החפץ במתכת טהורה מבלי שיתרחש תהליך כימי ביניהם.
האלקטרוליט מכיל את יוני המתכת המצפה, והתהליך מתרחש בתנאים מבוקרים של טמפרטורה, גודל הזרם וריכוז קבוע של אלקטרוליט.
ציפוי אלקטרוליטי משמש למספר מטרות:
א. ציפוי לצורך עמידות בפני איכול (קורוזיה) - יש מתכות המתפוררות כתוצאה מהתרכבותן עם החמצן שבאוויר, לדוגמא חלודה של ברזל. כדי להגן על ברזל ולמנוע מגע עם האוויר, נהוג לצפות אותו באבץ, על ידי אלקטרוליזה. ברזל מצופה אבץ נקרא פח מגולוון על שם החוקר האיטלקי גלוואני שפיתח את תהליך האלקטרוליזה.
ב. יצירת שכבת ציפוי נוי למתכות או לחומרים אחרים.
ג. מתן תכונות חדשות אשר אינן קיימות ללא הציפוי. לדוגמא: ציפוי שכבה של חומר מגנטי על מתכת לא מגנטית, או ציפוי שכבה קשה במיוחד על מתכת רכה.
ד. חיסכון במתכות יקרות והקטנת עלות המוצר על ידי שימוש בשכבה דקה של מתכת יקרה. לדוגמא: ציפוי חפצי נוי או ציפוי מגעים חשמליים במתכות יקרות, ציפויי ניקל של סמלים ופגושים במכוניות, ציפויי אבזרים באופנועים וכו'.

*216*
בדרך כלל יש לציפוי יותר מתפקיד אחד. זהב, לדוגמה, הוא מתכת בעלת מוליכות חשמלית מצוינת ועמידות טובה בפני איכול (קורוזיה), אולם מחירו גבוה מאוד. לכן מייצרים מתגים חשמליים מנחושת או מתערובת של נחושת עם מתכות זולות אחרות ומצפים אותם בשכבת זהב דקה מאוד. הזהב מונע מהמתכת המצופה להתקשר עם החמצן שבאוויר וליצור עמה תחמוצת, שהיא בעלת מוליכות חשמלית קטנה.
לציפוי של סכו"ם (סכין, כפית ומזלג) בכסף או בזהב די בשכבה דקה של 0.1 מילימטר. ציפוי כפיות הכסף נעשה על ידי טבילת כפיות באמבט אלקטרוליטי של תמיסת כסף חנקתי AgNO[3], שבו עובר זרם חשמלי. עוצמת הזרם העובר קובעת את העובי הרצוי של הציפוי.
(בספר איור, היעזר במנחה)
ציפויים חייבים לעמוד במספר דרישות טכנולוגיות:
א. קשיות ועמידות בפני בלאי. יש חשיבות לכך שהציפוי יהיה קשה, כדי שלא יהיה ניתן לפגוע בו בקלות, וכדי שיחזיק מעמד זמן ממושך. דוגמה לכך היא ציפוי קשה של ניקל וכרום בבוכנות של מנועי מכוניות, או ציפוי של ניקל באבזרים שונים של כלי רכב (סמלים, פגושים, וכדומה).
ב. הדבקה. כדי שהציפוי לא יתקלף, חשוב שתהיה הדבקה טובה על שטח הפנים. הציפוי מתחבר לאטומי המתכת לשם כך חשוב מאוד לנקות מכל לכלוך את שטח הפנים של המתכת, שאותה עומדים לצפות.
ג. אחידות. רצוי שהציפוי יהיה חופשי מנקבוביות, הנגרמות בדרך כלל בגלל אי נקיונות בתמיסה. כמו כן רצוי מאוד ששטח הפנים יהיה חלק ומבריק, ללא אזורים מחוספסים. ציפוי חלק כזה מושג בטכניקה מיוחדת, שבה סותמת המתכת המצפה את כל השקעים על שטח הפנים של המתכת התחתונה.
*217*
א. חלודה היא ודאי תופעה מוכרת לכם. מנו מספר חסרונות של התופעה בחיי היום יום.
ב. האם החלודה הינה תהליך כימי? נמקו!
ג. בדרך כלל נוהגים לצפות צינורות מים בציפוי אלקטרוליטי. מהי הסיבה לכך?
ד. לאיזו מטרה מצפים סכו"ם בכסף או בזהב?
ולאיזו מטרה מצפים מגעים מתכתיים בכסף או בזהב?
ה. איזה יון צריך להימצא במערכת אלקטרוליזה, שבעזרתה רוצים לצפות חפץ מתכתי ביסוד ניקל?
ו. החומר שממנו נוצר הציפוי, חייב להימצא במצב של תמיסה או במצב מותך. הסבירו מדוע.
ז. מדוע לא די לטבול את החפץ שאותו רוצים לצפות, בתמיסה האלקטרוליטית, אלא יש גם לחברו למעגל חשמלי סגור?
ח. לאיזה הדק של מקור הזרם יש לחבר את הגוף, שאותו רוצים לצפות, ומדוע?
*217*
א. יש חומרים שניתנים לפירוק על ידי חימום, כמו הסוכר. יש חומרים שניתנים לפירוק על ידי זרם חשמלי, כמו מים.
ב. פירוק חומרים על ידי זרם חשמלי נקרא אלקטרוליזה.
ג. חומרים שלא ניתן לפרק אותם נקראים יסודות.
ד. יסוד הוא חומר הבנוי מאטומים זהים.
תרכובת היא חומר המורכב מאטומים של יסודות שונים.
ה. יסודות שונים בנויים מאטומים שונים.
ו. לקבוצה של יסודות הדומים מאוד בתכונותיהם אנו קוראים "משפחה כימית".
ז. בטבלת היסודות ערוכים היסודות בשורות ובטורים, בהתאם למספרם האטומי ובהתאם לתכונות המשותפות.
ח. ניתן לחלק את היסודות לשתי קבוצות, בהתאם לדמיון בתכונות הכימיות שלהם:
1. קבוצת המתכות 2. קבוצת האל-מתכות.
ט. המתכות הן קבוצה של יסודות בעלי תכונות משותפות:
רובן מוצקות בטמפרטורת החדר, ניתנות לריקוע ובעלות ברק מתכתי. באטומים של המתכות יש אלקטרונים חופשיים, לכן המתכות מוליכות זרם חשמלי.
*218*
י. אל-מתכות הם קבוצה של יסודות בעלי תכונות משותפות:
רובן אינן מבריקות, אינן ניתנות לריקוע, בטמפרטורת החדר יש ביניהן חומרים מוצקים, ויש ביניהן נוזלים או גזים.
באטומים של האל-מתכות אין אלקטרונים חופשיים, לכן הן אינן מוליכות חשמל.
יא. המבנה החלקיקי של היסודות המתכתיים שונה מהמבנה החלקיקי של היסודות האל-מתכתיים. ההבדל ביניהם מתבטא בכך שהיסודות המתכתיים בנויים כצבר של אטומים, והיסודות האל-מתכתיים בנויים ברובם כמולקולות.
יב. גזים אצילים הם משפחה כימית שמאפייניה הם: הופעה בטבע כיסודות חופשיים ולא כתרכובות; העדר נטייה להגיב עם יסודות או עם חומרים אחרים.
*218*
א. ציינו אילו מבין החומרים הבאים הינם יסודות:
מים, סוכר, עץ, מימן, ברזל, נחושת, פחמן.
ב. ציינו "נכון" או "לא נכון" לגבי כל אחד מהמשפטים הבאים:
1. כל היסודות בנויים מאטומים.
2. כל האטומים של אותו היסוד זהים.
3. תרכובת בנויה משני יסודות או יותר.
4. יסוד בנוי מאותם אטומים.
5. אם מרתיחים מים, הם מתפרקים ליסודות מימן וחמצן.
6. כל היסודות מוליכים חשמל.
7. היסודות האל-מתכתיים מצויים בצד שמאל של טבלת היסודות.
ג. כתבו שמות של 7 יסודות מתכתיים וציינו את תכונותיהם המשותפות.
ד. חוט הלהט בנורת חשמל עשוי מהיסוד המתכתי טונגסטן. "חלל הנורה" מכיל יסוד שהוא גז אציל, ארגון. מדוע הוחלף האוויר שבחלל הנורה בגז אציל?
ה. לפנים השתמשו במימן להפרחת כדורים פורחים.
מהי התכונה העיקרית, שבגללה נבחר המימן להפריח כדורים פורחים?
ו. כיום משתמשים בהליום להפרחת כדורים פורחים. מהי התכונה שבגללה הוחלף המימן בהליום?
ז. עם איזו משפחה נמנה היסוד הליום?
ח. האם התנהגותו של הליום מאפיינת את שאר היסודות במשפחה זו?
ט. הציעו דרך להראות, כי המים הם תרכובת.
י. ברשימה הבאה של סימנים כימיים נפלה טעות. היכן?
ברזל = Fe
סידן = C
חמצן = O
מימן = H
*219*
*219*
כדי להדליק אש אנו משתמשים בגפרורים או במצת. זו פעולה שגרתית, שאנו עושים כמעט בכל יום. אולם מתוך הרגל אין אנו שואלים את עצמנו, מדוע הבערה אינה יכולה להתרחש מאליה?
החומרים בטבע בנויים ממולקולות או מצברים של אטומים. כל עוד האטומים קשורים זה לזה בגלל קיומם של כוחות משיכה מיוחדים הפועלים ביניהם, אין האטומים יכולים להתקשר לאטומים אחרים. לכן תחילה עליהם להיות מנותקים זה מזה, כלומר עליהם להיות אטומים לא קשורים.
כיצד ניתן לנתק קשרים בין אטומים במולקולה?
מהי תרומתו של הגפרור הבוער או של הניצוץ להתחלת הבערה?
ניתוק קשרים בין אטומים קשורים נעשה על ידי השקעת אנרגיית חום. החום, שמספק הגפרור או הניצוץ גורם לאטומים במולקולה לנוע מהר יותר, ועל ידי כך להתרחק זה מזה תוך התגברות על כוחות המשיכה שביניהם. האטומים המתרחקים מתנתקים זה מזה ונעשים אטומים לא קשורים.
נבחר בניסוי של בערת מימן כדי להסביר, מה מתרחש בעת בערת חומר. על בערת המימן למדתם כבר, בהיותכם בכיתה ז. לפניכם תצלום של הניסוי.
(בספר תמונה, היעזר במנחה)

*220*
*220*
מימן נוצר כתוצאה מהתגובה בין האבץ לבין החומצה הכלורית שהוכנסו לבקבוק. המימן שנוצר נפלט מבעד לצינורית הקבועה בפתח הכלי. המימן שנפלט החוצה מתערבב עם האוויר, אך שום תגובה לא מתרחשת ביניהם (איור א').
(בספר איור, היעזר במנחה)
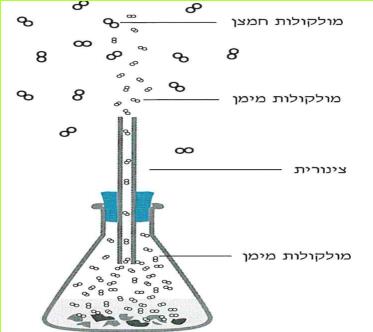
נוכל לתאר מצב זה בעזרת המבנה האטומי - מולקולרי:
מולקולות מימן ומולקולות חמצן נמצאות מעורבבות יחד בלי יכולת להתקשר ביניהן (איור ב').
(בספר איור, היעזר במנחה)

*221*
כאשר מקרבים גפרור בוער לפתח הצינורית. מופיעה להבה של "נר מימן" (איור ג'). קירוב גפרור בוער לתערובת של שני הגזים - מימן וחמצן - גרם לניתוק הקשרים בין אטומים בחלק ממולקולות המימן ובחלק ממולקולות החמצן.
(בספר שלושה איורים, היעזר במנחה)
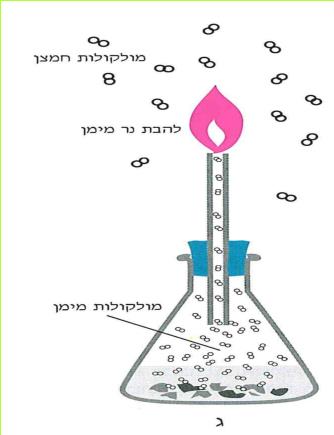
את "תמונת" המצב החדש נוכל לתאר בעזרת המבנה האטומי-מולקולרי בדרך הבאה (איור ד'):
כאשר אטומים שאינם קשורים נפגשים, הם עשויים להתקשר האחד עם השני. כאשר שני אטומי מימן לא קשורים נפגשים עם אטום חמצן ומתקשרים איתו, נוצרת מולקולת מים.
נוכל לתאר שינוי כזה בעזרת המבנה האטומי-מולקולרי (איור ה').
*222*
כתוצאה מהתקשרות אטומי מימן ואטומי חמצן נפלטת אנרגיה רבה בצורת חום ואור (איור ו').
(בספר איור, היעזר במנחה)
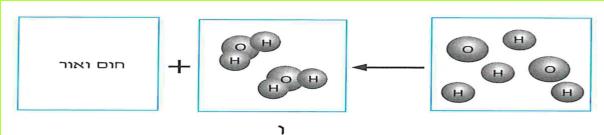
החום הנפלט גורם לניתוק קשרים בין אטומי חמצן במולקולות נוספות של חמצן, וכן לניתוק קשרים בין אטומי מימן במולקולות מימן נוספות.
כדי לפשט את האיור הבא (איור ז') נמנענו הפעם מלתאר את שלב ניתוק הקשרים בין האטומים במולקולות. הסתפקנו בתיאור המולקולות המשתתפות בתהליך הבערה, וברישום התוצר הסופי. אך צריך להיות ברור, כי כדי שיווצרו מולקולות מים, אטומי המימן והחמצן חייבים להיות במצב של אטומים בודדים ולא במצב של אטומים קשורים. עיינו באיור ז' וענו על השאלות הבאות.
(בספר איור, היעזר במנחה)
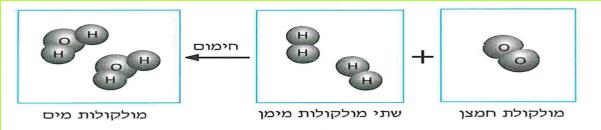
א. כמה מולקולות מים נוצרו בתגובה בין שתי מולקולות מימן ומולקולת חמצן?
ב. האם הופעתן של מולקולות מים, כתגובה בין החמצן למימן, יכלה להתרחש בלא שמולקולות החמצן ומולקולות המימן יתפרקו? נמקו!
ג. האם תהליך בערת המימן היה יכול להתרחש ללא פעולת ההצתה שנעשית באמצעות גפרור בוער או ניצוץ? נמקו!
*223*
בערת מימן היא דוגמה של תהליך כימי. כדי שתהליך כימי יתקיים, יש לגרום לניתוק קשרים קיימים בחומרים המגיבים. פעולה זו דורשת השקעת אנרגיה. לפעמים די באור השמש או בחום הקיים בחדר, כדי שניתוק הקשרים יתחיל.
א. לפעמים די בניצוץ אחד כדי לגרום לשרפה גדולה. הסבירו מדוע. את תשובתכם כתבו מנקודת מבט של המבנה האטומי של החומר.
ב. לפניכם שורה של שינויים בחומר. אילו מהשינויים הם תוצאה של תהליך כימי? נמקו את בחירתכם.
1. התעבות אדי מים לטיפות.
2. התמוססות של סוכר במים.
3. שרפה של סוכר.
4. אלקטרוליזה של מים.
5. הרתחה של מים.
ג. חומרים העשויים להתפרק בנוכחות אור שמש מאוכסנים בכלים אטומים לאור. מדוע?
ד. פעולת הסוללה החשמלית היא תוצאה של תהליכים כימיים, המתרחשים בחומרים שבתוכה. כאשר כל החומרים המגיבים משתנים לתוצרים - חדלה הסוללה לפעול. לאור מידע זה, הסבירו מדוע נהוג לשמור סוללות רזרביות בתא ההקפאה של המקרר.
ה. יש מקרים שבהם דלקה פורצת לכאורה מאליה - בלי שמשהו יגרום להצתה מכוונת. כיצד ניתן להסביר זאת?
ו. לפניכם ארבעה איורים. התאימו כל אחד מהם למקרא.
1. אטומי חמצן בלתי קשורים;
2. מולקולת חמצן ומולקולת מימן.
3. מולקולת מים;
4. אטומי מימן בלתי קשורים.
(בספר ארבעה איורים, היעזר במנחה)
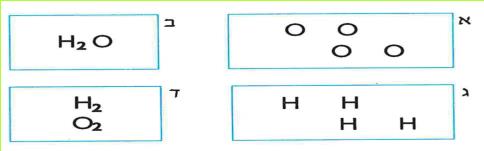
*224*
- כדי לנתק קשרים בין אטומים יש להשקיע אנרגיה (לדוגמה על ידי חימום).
- תהליך כימי הוא תהליך של ניתוק קשרים קיימים ויצירת קשרים חדשים בין אטומים.
*224*
ביצירת מולקולות חדשות חייבים להיווצר קשרים חדשים בין האטומים. דוגמה לכך ראינו בתהליך בערת המימן.
המולקולה החדשה שנוצרה הייתה מולקולת מים. מולקולת המים נוצרה כתוצאה מיצירת קשרים בין שני אטומי מימן לאטום חמצן אחד.
(בספר איור, היעזר במנחה)
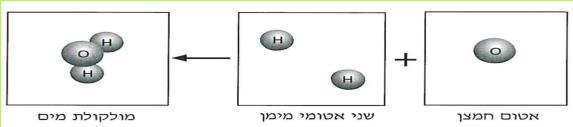
יצירת קשר בין שני אטומים היא פעולה הפוכה לניתוק קשר. לכן יצירת קשר בין שני אטומים היא תהליך של שחרור אנרגיה.
- מולקולות מימן (נחוצה השקעת אנרגיה לניתוק קשרים) + מולקולות חמצן (נחוצה השקעת אנרגיה לניתוק קשרים) - מולקולות מים (שחרור אנרגיה בהיווצרות קשרים חדשים)
בתהליך שרפת המימן הושקעה אנרגיית חום כדי לנתק את הקשרים בין האטומים הקשורים. תופעה זו, של ניתוק קשרים תוך השקעת אנרגיה ויצירת קשרים חדשים תוך שחרור אנרגייה, מאפיינת את כל התהליכים הכימיים.
*225*
בעזרת האיור הבא נוכל לתאר את כלל השינויים באנרגיה, המתרחשים בתהליך כימי כלשהו.
- א. השקעת אנרגיה לצורך ניתוק קשרים קיימים בין אטומים+ ב. שחרור אנרגיה כתוצאה מיצירת קשרים חדשים בין האטומים = תהליך כימי
תהליך אנדותרמי: מתרחש כאשר כמות האנרגיה המושקעת לניתוק קשרים קיימים גדולה מכמות האנרגיה, המשתחררת בעת היווצרות הקשרים החדשים. תהליך אנדותרמי הוא תהליך הצורך אנרגיה מהסביבה.
תהליך אכסותרמי: מתרחש כאשר כמות האנרגיה המשתחררת בעת היווצרות קשרים חדשים גדולה מכמות האנרגיה, המושקעת לניתוק קשרים קיימים. תהליך אכסותרמי הוא תהליך שמשחרר אנרגיה לסביבה.
לאור האמור עד כה, האם תהליך בערת המימן הוא תהליך אנדותרמי או תהליך אכסותרמי? נמקו!
בעבודה זו תבדקו את שינויי הטמפרטורה המתרחשים בתהליכים כימיים.
את תיאור הניסוי ותוצאותיו נערוך בעזרת הטבלה הבאה.
העתיקו את הטבלה למחברת והשלימו את החסר בתום כל ניסוי וניסוי.
ניסוי | החומרים המגיבים בתהליך הכימי | טמפרטורה התחלתית | טמפרטורה סופית | הפרש מרבי בטמפרטורה | סוג התהליך (אכסותרמי או אנדותרמי) |
א | אמוניום כלוריד ובריום הידרוקסיד | -- | -- | -- | -- |
ב | תמיסה מימית של נחושת כלורית ונייר אלומיניום | -- | -- | -- | -- |
שימו לב: יש להפסיק את מדידת הטמפרטורה, לאחר שהטמפרטורה תגיע לעלייה המרבית או לירידה המרבית.
*226*
(בספר 2 תמונות, היעזר במנחה)

א. הכניסו לבקבוק את התרכובת אמוניום כלוריד מוצק ומדדו את הטמפרטורה ההתחלתית של החומר.
ב. קרבו לפתח הבקבוק פיסת נייר לקמוס אדום ספוג במים. האם הבחנתם בשינוי צבע בפיסת הנייר?
ג. הוסיפו לבקבוק כמות דומה של התרכובת בריום הידרוקסיד מוצק. עטפו את הבקבוק בחומר מבודד. ערבבו היטב את החומרים שבבקבוק בעזרת מקל בחישה.
ד. מדדו את הטמפרטורה של החומרים שבבקבוק בעזרת מד-טמפרטורה.
ה. קרבו שוב את פיסת נייר הלקמוס האדום לפתח הבקבוק. האם חל שינוי בצבעו?
הסבירו את השינוי בצבע.
א. לפניכם כוס בישול המכילה תמיסת נחושת כלורית עד למחצית נפחה. מדדו את הטמפרטורה ההתחלתית של התמיסה.
ב. הוסיפו לתמיסה מספר פיסות של נייר אלומיניום. התבוננו בשינויים המתרחשים בתמיסה עם הכנסת פיסות האלומיניום.
ג. מדדו את הטמפרטורה של התמיסה כדקה לאחר הכנסת נייר האלומיניום לתמיסה.

*227*
א. מדוע עטפנו את הבקבוק בניסוי א' בחומר מבודד?
ב. האם ערבוב שני החומרים בניסוי א' יצר חומר חדש? נמקו!
ג. באיזה ניסוי הושקעה כמות אנרגיה גדולה מכמות האנרגיה שהשתחררה? נמקו!
ד. באיזה ניסוי השתחררה כמות אנרגיה גדולה מכמות האנרגיה שהושקעה בתהליך? נמקו!
ה. באיזה ניסוי היה התהליך אנדותרמי, ובאיזה ניסוי היה התהליך אכסותרמי?
*227*
א. כאשר אטומים מתקשרים זה לזה, אנו אומרים שנוצר קשר כימי.
ב. אטומים הקשורים ביניהם בקשרים כימיים יוצרים מולקולות.
כל עוד האטומים במולקולה קשורים זה לזה, אין הם יכולים ליצור קשרים חדשים.
ג. כדי לנתק קשר כימי יש להשקיע אנרגיה.
ד. אטומים שאינם קשורים יכולים ליצור קשרים חדשים. בעת התהוות קשרים כימיים חדשים נפלטת אנרגיה.
ה. תהליך כימי הוא תהליך של ניתוק קשרים קיימים בין אטומים ויצירת קשרים חדשים.
ו. כדי שתהליך כימי ייצא לפועל, יש צורך בהשקעת אנרגיה להתחלת התהליך.
ז. לפעמים די באנרגיית החום בטמפרטורת החדר או באנרגיית אור השמש, כדי שתהליך כימי ייצא לפועל.
ח. בתהליך אכסותרמי משתחררת אנרגיה לסביבה.
אנרגיה זו יכולה להופיע כחום או כאור או כשניהם גם יחד.
ט. בתהליך אנדותרמי מושקעת אנרגיה. מקורה של אנרגיה זו יכול להיות חימום ממושך מבחוץ. דרך נוספת היא קליטת אנרגיה מהחומרים המשתתפים בניסוי, דבר המביא לירידת הטמפרטורה של החומרים ולהתקררותם.
*228*
*228*
א. מדוע יש להשקיע אנרגיה בכל תהליך כימי?
ב. בימי הקיץ החמים פורצת לפעמים אש מאליה. כיצד ניתן להסביר תופעה זו?
האם אין התופעה מעמידה בספק, את אשר למדתם עד כה? נמקו!
ג. לפניכם ניסוח של תהליך כימי:
- מולקולות חומר א' + מולקולות חומר ב' - חימום (להתחלת התהליך בלבד) - מולקולות חומר ג' + מולקולות חומר ד' + אנרגיית חום
1. האם תהליך זה הוא אכסותרמי או אנדותרמי? נמקו!
2. מהו לדעתכם תפקיד החימום?
3. האם התגובה הייתה מתרחשת ללא פעולת החימום? הסבירו!
ד. כאשר הכינו תערובת משני חומרים שונים, שהטמפרטורה של כל אחד מהם בנפרד הייתה 18 מעלות צלזיוס, ירדה הטמפרטורה ל-20 מעלות צלזיוס - והופיע חומר חדש. נסו להסביר את פשר הירידה בטמפרטורה במהלך התהוות החומר החדש. היעזרו במונחים: ניתוק קשרים והתהוות קשרים.
ה. מדוע די בניצוץ אחד כדי שלהבת גז דליק תמשיך לדלוק מאליה?
ו. ציינו "נכון" או "לא נכון" ליד המשפטים הבאים. נמקו את בחירתכם.
1. כדי לנתק יותר קשרים יש להשקיע יותר אנרגיה.
2. ככל שנוצרים יותר קשרים - משתחררת יותר אנרגיה.
3. בכל תהליך כימי האנרגיה המשתחררת גדולה מהאנרגיה המושקעת.
4. כאשר אנרגיה נפלטת מתהליך כימי, יורדת הטמפרטורה של מערכת הניסוי.
ז. מה קורה בתהליך, שבו לא ניתן להבחין בשינוי בטמפרטורה? האם הדבר מעיד שלא התרחש תהליך כימי? הסבירו!
*229*
*229*
בחיי היום יום אנו רגילים לקרוא לבערה בשם שרפה. בדרך כלל כשמדברים על שרפה הכוונה לשרפת קוצים בשדה ולשרפת קרשים וניירות במדורה. כל אלה הם תהליכי בערה, אך לא רק ניירות, קרשים וצמחים נשרפים-בוערים, אלא אף מתכות. בשנה שעברה, כשלמדתם על הבערה, הבערתם את המתכות: מגנזיום (Mg) וברזל (Fe).
בתהליכי הבערה האלה מתרכבים היסודות ברזל ומגנזיום עם החמצן שבאוויר. בתהליך התרכובת כזה משתחרר חום רב ואור חזק.
הדגמה של בערת מגנזיום:
(בספר תמונה, היעזר במנחה)
- מגנזיום+חמצן - חימום - מגנזיום חמצני

*230*
הדגמה של בערת ברזל
(בספר תמונה, היעזר במנחה)
- ברזל+חמצן - חימום - ברזל חמצני

א. מה המשותף לבערה של מגנזיום ולבערה של ברזל?
ב. במה שונה בערת מגנזיום מבערת ברזל?
ג. מנין מגיע החמצן המשתתף בבערת שתי המתכות - ברזל ומגנזיום?
כאשר שורפים חומר כלשהו מתקבלים חומרים, שתכונותיהם שונות בצורה בולטת מתכונות החומרים שמהם הם נוצרו. בתהליך הבערה נוצרים חומרים חדשים. אנו יודעים כבר, כי תהליך שבו נוצר חומר חדש נקרא תהליך כימי. לכן נוכל לומר שהבערה היא תהליך כימי.
הבערה היא תהליך כימי, שבו מתרכב החומר הבוער עם חמצן. הבערה מלווה בפליטת חום.
*231*
(בספר שתי תמונות, היעזר במנחה)
א. מדוע נכבית הכוהליה, כאשר מכסים אותה?
ב. כאשר מכסים נר דולק בכוס זכוכית, הנר כבה לאחר זמן קצר. כאשר מכסים את הנר בצנצנת זכוכית גדולה, הנר כבה לאחר זמן ממושך יותר. הסבירו מדוע.

ג. אפשר לכבות מדורה בעזרת חול. כיצד החול מכבה את האש?

*232*
*232*
גז בישול, נפט, בנזין ושעוות פרפין הם תערובות. כל תערובת כזו מכילה מספר תרכובות פחמימניות. בתרכובת פחמימנית המולקולה בנויה מאטומים של פחמן (C) ומאטומים של מימן (H) בלבד. (פח-מימן = פחמן ומימן). גז הבישול, לדוגמה, הוא תערובת של שתי תרכובות פחמימניות: פרופאן ובוטאן.
לפניכם הרכב של מולקולות פחמימניות הנמצאות בגז בישול:
שם הפחמימן | פרופאן | בוטאן |
נוסחתו | C[3]H[8] | C[4]H[10] |
נוסחת מבנה של המולקולה | (היעזר במנחה) | (היעזר במנחה) |
דגם של המולקולה | (היעזר במנחה) | (היעזר במנחה) |
א. התבוננו בדגמים של שתי המולקולות. איזה עיגול מסמל את אטומי הפחמן? נמקו!
ב. במה דומות המולקולות של שני הפחמימנים - פרופאן ובוטאן? ובמה הן שונות זו מזו?
בזמן הבערה מתקשרים אטומי המימן של הפחמימן עם אטומי החמצן שבאוויר, ונוצרים מים.
- מימן + חמצן - מים
*233*
גם אטומי הפחמן שבמולקולת הפחמימן מתקשרים עם אטומי חמצן שבאוויר, ונוצר חומר חדש: פחמן דו חמצני.
- פחמן + חמצן - פחמן דו חמצני
ג. לפני השלב שבו מתקשרים אטומי המימן ואטומי הפחמן עם אטומי החמצן שבאוויר - מתרחש שלב קודם. מהו?
התרכבות הפחמן והמימן עם החמצן מלווה בשחרור אנרגיית חום ואנרגיית אור. ניתן לכתוב ניסוח אחד, שיכלול את שתי התגובות בתהליך הבערה:
פחמימן + חמצן - פחמן דו חמצני + מים + חום ואור
את נוכחות המים נבדוק בעזרת נייר קובלט כלורי כחול. בבדיקה זו כבר השתמשנו (עמ' 180) בנושא פירוק הסוכר. דרך הבדיקה: טובלים בתוך החומר הנבדק נייר סינון הספוג בחומר קובלט כלורי כחול. אם החומר הנבדק מכיל מים, ישתנה צבע הנייר מכחול לוורוד.
(בספר תרשים, היעזר במנחה)
נייר קובלט כלורי כחול - נייר קובלט כלורי ורוד
מים - נייר קובלט כלורי ורוד
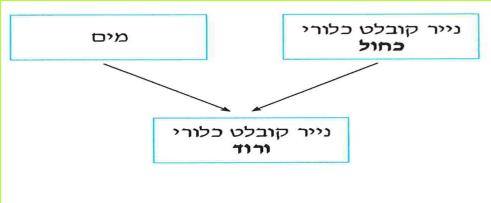
*234*
פחמן דו חמצני מזהים בעזרת מי סיד צלולים. בזיהוי כזה כבר עסקתם בשנה שעברה. כאשר פחמן דו חמצני בא במגע עם מי סיד צלולים, מאבדים מי הסיד את שקיפותם ונעשים עכורים.
(בספר תרשים, היעזר במנחה)
מי סיד צלולים - תמיסה עכורה
פחמן דו-חמצני - תמיסה עכורה
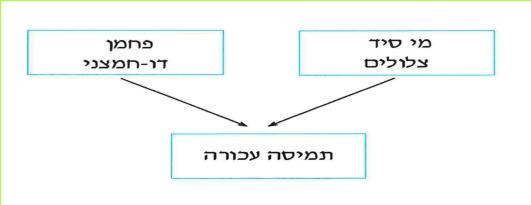
א. האם מי סיד ונייר קובלט כלורי יכלו לשמש כבוחנים (אינדיקטורים) לו הגיבו באותה צורה גם עם חומרים אחרים? נמקו!
ב. בפעולת הנשיפה אנו פולטים אדי מים וכמות גדולה יחסית של הגז פחמן דו חמצני. מה יקרה, לדעתכם, לתמיסת מי סיד צלולים, כאשר ננשוף לתוכה מספר דקות? נמקו!
א. לפניכם שתי צלחות פטרי שבכל אחת מהן קבוע נר. הדליקו את אחד הנרות וכסו אותו בכוס זכוכית גדולה. את הכוס יש להניח בגובה של 3.5 ס"מ מפני השולחן (ראו תצלום בעמוד הבא).
ב. כאשר יופיעו אדים על דופן הכוס, הרחיקו את הכוס מהנר בעזרת מטלית וכבו את הנר. ספגו את טיפות הנוזל הזעירות בעזרת נייר קובלט כלורי כחול.
1. האם חל שינוי בצבע הנייר במקומות שבהם נספגו טיפות הנוזל? אם כן מהו?
2. על מה מעיד השינוי בצבע הנייר?
ג. מזגו תמיסת מי סיד צלולים לכל אחת משתי צלחות הפטרי והעבירו צלוחית אחת מחוץ למגש.
*235*

ד. הדליקו שוב את הנר שעל המגש וכסו אותו בכוס, כפי שעשיתם בפעם הראשונה והמתינו מספר דקות.
הסירו את הכוס. הסתכלו בצבע התמיסה שבצלחת.
1. האם חל שינוי בצבע התמיסה? מהו השינוי?
2. מהי השערתכם לסיבת השינוי.
3. האם בצלחת השנייה חל שינוי דומה? מדוע?
4. מדוע לדעתכם, הוספנו צלחת שנייה בניסוי זה?
ה. השלימו במחברותיכם, בעזרת התרשים הבא, את שמות התוצרים הנוצרים בעת בערה של פחמימן.
(בספר תרשים, היעזר במנחה)
פחמימן + חמצן - -- + --
1. מדוע בתהליך של בערת ברזל או בערת מגנזיום לא נוצרים מים ופחמן דו חמצני?
2. האם בעת בערת מימן נוצר פחמן דו חמצני? מדוע?

*236*
*236*
א. נדליק מבער גז ונתבונן בצבע הלהבה.
ב. בעזרת אטב נחזיק לוח זכוכית מעל ללהבה ונמתין כחצי דקה.
נתבונן בלוח הזכוכית ונראה, כי לא חל בו כל שינוי הנראה לעין.
(בספר שלוש תמונות, היעזר במנחה)

ג. עתה נסגור את פתחי האוויר שבבסיס המבער, כך שישאר רק מעבר צר ביותר לאוויר.
האם חל שינוי בצבעה של הלהבה? מהו השינוי?
ד. נפתח את פתחי האוויר מחדש.
1. האם הלהבה עדיין צהובה?
2. מה גרם לשינוי בצבע הלהבה?
ניתן להבחין בשינוי נוסף לשינוי בצבע הלהבה.
נחזיק לוח זכוכית מעל ללהבה הצהובה ונמתין זמן קצר.
נתבונן בלוח הזכוכית: על גבי הלוח הצטבר חומר שחור. זהו פחמן מוצק, הנקרא פיח. ניתן לראותו נישא מעל הלהבה הצהובה בגופיפים שחורים.
*237*
בשני המקרים השתמשנו באותו חומר דלק (גז בישול) ובאותו מבער. אך התוצאות של תהליך הבערה שהתרחשו בשניהם היו שונות. הבה נברר את הסיבה לכך.
תחילה ננסה את תהליכי הבערה, שהתרחשו בשני המקרים.
- גז בישול + חמצן בכמות רבה - פחמן דו חמצני + אדי מים + אור כחלחל
- גז בישול + חמצן בכמות מעטה - פחמן דו חמצני + אדי מים + פחמן מוצק + אור צהבהב
ה. העתיקו את הטבלה הבאה למחברת. עיינו בשני הניסוחים של בערת גז הבישול והשלימו את החסר בטבלה.
במבער | החומר הבוער | כמות החמצן המסייעת לבערהמעטה/ רבה | צבע הלהבה | הןפעת פיחכן/ לא |
א. פתחי אוויר פתוחים | -- | -- | -- | -- |
ב. פתחי אוויר סגורים | -- | -- | -- | -- |
ו. מהי הסיבה להבדל בין שתי הבערות - זו שהתרחשה במבער עם פתחי אוויר פתוחים וזו שהתרחשה במבער עם פתחי אוויר סגורים?
*238*
כידוע לכם, החמצן הוא החומר המסייע לבערה. בלי החמצן אין חומרי דלק וחומרים אחרים יכולים לבעור. כאשר כמות מספקת של חמצן מגיעה אל חומר הדלק, אטומי הפחמן ואטומי המימן שבמולקולות חומר הדלק מתקשרים עם אטומי חמצן ויוצרים מולקולות של פחמן דו חמצני (CO[2]) ומים (H[2]O). במקרה כזה אנו אומרים שהבערת שלמה. השם בערה שלמה ניתן, משום שהפחמן הדו חמצני והמים אינם יכולים להתרכב עם כמויות נוספות של חמצן.
במקרים שבהם לא מגיעה כמות מספקת של חמצן אל חומרי הדלק, נותרים אטומי פחמן רבים חופשיים.
אטומים אלה מתקשרים זה לזה לצברים של אטומי פחמן, הנראים כחלקיקים שחורים. זהו הפיח. בערה כזו, שבה חלק מן האטומים של חומר הדלק אינם הופכים ל- CO[2] ול- H[2]O, נקראת בערה חלקית.
ז. באיזה מבער מבין השניים התרחשה בערה שלמה? נמקו!
ח. לפעמים קורה, שבזמן שרפה נושבת רוח. בעקבות משבי הרוח מתלבה האש ועוצמתה גוברת. מדוע?
*238*
כאשר מוגבלת הספקת החמצן לתהליך הבערה, כמות החמצן המתרכבת עם האטומים של מולקולות הדלק אינה מספיקה לבערה שלמה. בתנאים כאלה של חוסר בחמצן עלול להיווצר תוצר נוסף של הבערה החלקית. תוצר זה הוא פחמן חד חמצני (CO).
- גז בישול + מעט חמצן – פחמן דו חמצני + אדי מים + פחמן חד חמצני + להבה צהבהבה
להבה
החומר פחמן חד חמצני הוא גז בטמפרטורת החדר. הוא חסר צבע וחסר ריח ורעיל ביותר.
*239*
פגיעתו של הפחמן החד חמצני באדם ובבעלי חיים אחרים נגרמת עקב תכונתו להתקשר אל כדוריות הדם האדומות. התקשרות זו פוגעת ביכולתן של הכדוריות האדומות להוביל חמצן לתאי הגוף. ידוע לכם מלימודי הביולוגיה, כי תאי הגוף זקוקים לאספקת חמצן כדי להתקיים. בלא אספקת חמצן אין תאי הגוף יכולים לפעול.
רוב הזיהום בפחמן חד חמצני באוויר מקורו בבערה חלקית של דלק במנועי מכוניות, רכבות ומטוסים. כאשר ריכוז הפחמן החד חמצני עולה על התקן המותר (חלק אחד של פחמן חד חמצני בעשרת אלפים חלקים של אוויר, 1/10,000, רוב בני האדם מרגישים במחושי ראש ובסחרחורת. תופעות אלה נגרמות בגלל הספקה לקויה של חמצן לגוף.
באזורים עמוסי תחבורה, כמו בריכוזים עירוניים גדולים, עלול ריכוז הפחמן החד חמצני באוויר לעלות על ריכוז של 1/10,000.
פחמן C
פחמן חד חמצני CO
פחמן דו חמצני CO[2]
מים H[2]O
מקור נוסף של זיהום ב-CO הינו בערת גז בישול או נפט בתנור חימום. הסכנה גדולה במיוחד, כאשר נמצאים בחדר סגור ובלתי מאוורר, שבו דולק תנור חימום, הפועל על גז בישול או נפט. במקום כזה, הן התנור והן האנשים צורכים את החמצן שבאוויר החדר.
כשכמות החמצן הולכת ופוחתת באוויר החדר, מתחילה להתרחש בתנור בערה חלקית. אחד מתוצרי הבערה החלקית הינו הפחמן החד-חמצני. מאחר שלגז זה
*240*
אין ריח ואין צבע, אין אפשרית לדעת על קיומו בסביבה, ועל כן הסכנה הטמונה בו גדולה שבעתיים.
לצערנו, קרו מקרים לא מעטים של שאיפה לא מודעת של פחמן חד-חמצני, בגללה קיפחו בני אדם את חייהם. עלינו לדאוג לאוורור הדירה באופן קבוע בעת הפעלת תנורי חימום הפועלים על גז או נפט. בדרך זו נמנע סכנות מיותרות מבני ביתנו.
בכל מקרה של הרעלה כזו יש להזדרז ולהעביר במהירות את הנפגע לסביבה של אוויר צח, ולהזעיק עזרה רפואית.
א. מדוע חומרי דלק בוערים בסביבה בה מצוי רק חמצן במהירות גדולה מאשר באוויר?
ב. התבוננו בתרשים הבא: אילו מבין תוצרי הבערה של הדלק הם תוצרי בערה שלמה?
C
CO
CO[2]
H[2]O
ג. שהייה ממושכת בחניון כלי-רכב תת קרקעי פעיל מאוד גורמת לסחרחורת ולפעמים אף לבחילה. נסו להסביר מדוע.
ד. על מה יש להקפיד מבחינה בטיחותית בימים קרים, כאשר מפעילים תנורי חימום של נפט או גז בחדרי המגורים? מדוע?
ה. לפניכם שלושה סוגי תנורי חימום: תנור נפט בלא ארובה, תנור חימום חשמלי ותנור גז שתוצרי הבערה שלו נפלטים דרך ארובה אל מחוץ לדירה. איזה מהם מסוכן יותר לשימוש בחדר מגורים? נמקו!
*241*
*241*
א. הבערה הינה תהליך כימי. בתהליך זה מתרכבים חומרים שונים עם חמצן, תוך פליטת חום ואור.
ב. בבערה של היסוד מגנזיום באוויר נוצר תוצר אחד - מגנזיום חמצני.
ג. בבערה של היסוד ברזל באוויר נוצר תוצר אחד - ברזל חמצני.
ד. בבערה שלמה של פחמימנים נוצרים פחמן דו חמצני ואדי מים.
בבערה לא שלמה של פחמימנים נוצרים גם הגז פחמן חד חמצני וחלקיקי פיח.
ה. בערה לא שלמה מתרחשת, כאשר כמות החמצן קטנה מהכמות הנדרשת לקיום בערה שלמה.
ו. תוצרי הבערה השלמה אינם יכולים להמשיך ולהתרכב עם החמצן. לעומתם, חלק מתוצרי הבערה הלא שלמה יכולים להמשיך ולהתרכב עם חמצן.
ז. הגז פחמן חד חמצני הוא חומר רעיל ומסוכן לאדם ולבעלי חיים אחרים. ריכוזים זעירים של פחמן חד חמצני עלולים לגרום לסחרחורת ובחילה. ריכוזים יותר גבוהים של פחמן חד חמצני עלולים לגרום להתעלפות, לאובדן הכרה ואף לסכנת חיים.
ח. רוב הזיהום בפחמן חד חמצני באוויר מקורו בבערה לא שלמה של דלק במנועי מכוניות.
ט. באיזורים שבהם קיימת תחבורה סואנת, יש סכנה חמורה לזיהום האוויר בגז פחמן חד חמצני בריכוזים גבוהים יותר.
*241*
א. השלימו את החסר:
1. הבערה היא תהליך שבו מתרכבים חומרים שונים עם: --.
2. התוצרים האפשריים מבערה של רוב חומרי הדלק הם: -- -- -- --.
ב. השוו בערה שלמה לבערה שאינה שלמה. ענו על המצבים המתוארים ב"כן" או "לא".
(ריק) | חומר דלק מתרכב עם חמצן | נוצרים אדי מים | נוצר CO[2] | נוצר CO | נשארות מולקולות דלק שלא התרכבו | עלולה להיות הרעלה |
בערה שלמה | -- | -- | -- | -- | -- | -- |
בערה חלקית | -- | -- | -- | -- | -- | -- |
*242*
ג. קיימות שיטות אחדות לכיבוי שרפה. רובן מבוסס על פעולות ההפרדה ביו החמצן לחומר הבוער. ציינו שתי שיטות שבהן מנוצל רעיון זה. הסבירו את תשובתכם.
ד. מדוע סגירת החלונות והפתחים בדירה עלולה להיות מסוכנת לבני הבית, בשעה שתנור נפט או גז דולק בדירה?
ה. האם סכנה דומה קיימת כאשר פועל תנור חימום חשמלי? נמקו!
ו. לפניכם שלושה תרשימים המתארים שלושה מיכלים שונים. עיינו בהם.
1. באיזה מהם יכבה הנר ראשון? נמקו!
2. באיזה מהם יכבה הנר אחרון? נמקו!
(בספר שלושה איורים, היעזר במנחה)
א. מיכל אוויר בנפח 10 ליטר
ב. מיכל אוויר בנפח 5 ליטר
ג. מיכל אוויר בנפח 5 ליטר
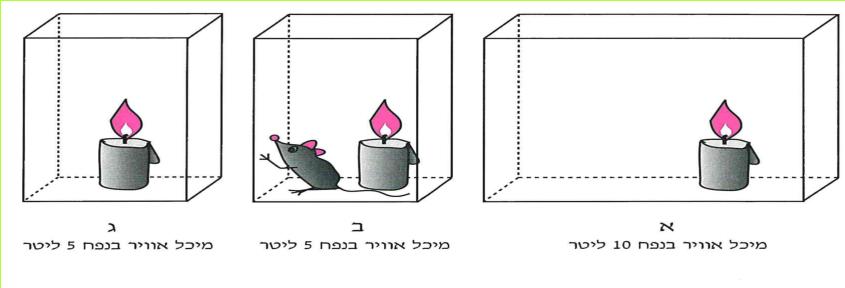
ח. במה דומה הבערה של מגנזיום באוויר או של ברזל באוויר לבערה של פחמימן באוויר? ובמה הן שונות זו מזו?
*243*
*243*
עד כה פגשנו תהליכים כימיים שונים. בכולם מולקולות המגיבים התפרקו ומהן נוצרו מולקולות חדשות של התוצרים. בכיתה ז' עסקתם בשאלה, אם המסה של החומרים שנוצרו בתהליך כימי (התוצרים) שווה למסה של החומרים שהשתתפו בתהליך (המגיבים).
מסת התוצרים = ? מסת המגיבים
השאלה נשאלה בשל העובדה המוכרת, שמכמות גדולה של עצים וקרשים המושלכת למדורה נותרת כמות קטנה של אפר.
להיכן נעלמה מרבית כמות החומר של העצים והקרשים?
כדי להשיב על שאלה זו נעיין בניסוי הבא ובתוצאותיו.
(בספר שתי תמונות, היעזר במנחה)
א. מגיבים

ב. תוצרים

א. נכניס לבקבוק של 100 סמ"ק שתי כפיות סודה לשתיה. נמזוג בכוס 20 סמ"ק חומץ ביתי. נניח את הבקבוק ואת הכוס על כף המאזניים ונאזן אותם (תצלום א').
ב. נמזוג את החומץ לבקבוק.
1. הסתכלו על המאזניים: מה קרה למסה של התוצרים (תצלום ב')?
2. כיצד תסבירו את השינוי במסה?
*244*
ג. חזרו על הניסוי בדרך אחרת: הכניסו שתי כפיות סודה לשתייה לבקבוק. מזגו לתוך בלון גדול 20 סמ"ק חומץ ביתי. הלבישו את פיית הבלון על פי הבקבוק ואזנו את המאזניים (תצלום ג').
ד. שפכו את החומץ מהבלון לבקבוק. כתוצאה מהתגובה בין החומץ לסודה לשתייה נוצר פחמן דו חמצני, הממלא את הבלון (תצלום ד').
(ניסוי זה בוצע בריק. אם נבצע אותו בלחץ אטמוספרי, האוויר החיצון יפעיל כוח על הבלון המלא גז (כוח עילוי) ואז יופר איזון המאזניים.)
(בספר שתי תמונות, היעזר במנחה)

ה. האם בשלב השני נשמרה המסה? כיצד אתם יודעים זאת?
ו. מדוע בשלב השני לא חל שינוי במסת התוצרים?
על פי חוק שימור המסה:
מהניסוי המתואר למדנו, שכדי שנוכל לאשר את חוק שימור המסה, הבדיקה צריכה להיעשות במערכת סגורה.
מערכת סגורה היא מערכת ניסוי המצויה בתוך כלי סגור, כך שחומרים המשתתפים בתהליך הכימי, אינם יכולים לצאת מהכלי, וחומרים מבחוץ אינם יכולים להכנס לתוכו.
חוק שימור המסה נקבע על סמך התוצאות, שנתקבלו מתהליכים כימיים רבים. בכל תהליך שנבדק נמצא, כי המסה של החומרים המגיבים שווה תמיד למסה של התוצרים.
*245*
א. שתיל הוא צמח קטן מידות וצעיר לימים, שעם חלוף השנים נעשה לעץ גדול מידות. האם שינוי זה, הקשור בצמיחה של השתיל, אינו סותר את חוק שימור המסה? הסבירו!
ב. האם לאור פעולות הכרייה הרבות הנעשות במקומות שונים בעולם, כמו: כריית זהב, פחם, מחצבים אחרים וקידוחי נפט, יש לחשוש שמסת כדור הארץ תלך ותקטן? הסבירו!
ג. יש הנוהגים להניח בארונות הבגדים שקיות מנוקבות, המכילות כדורי נפטלין, נגד עש הבגדים. לאחר זמן מה נותרות השקיות ריקות. האם תופעה זו נוגדת את חוק שימור המסה? הסבירו!
*245*
דוגמה נוספת לחוק שימור המסה נביא מתהליך כימי, שבו עסקנו השנה: פירוק מים על ידי חשמל (אלקטרוליזה של מים). כאשר מפרקים מים, מסת המים שווה תמיד למסה הכוללת של המימן ושל החמצן, המתקבלים בתהליך הפירוק.
18 גרם מים - פירוק - 16 גרם חמצן + 2 גרם מימן
לו פירקנו 9 גרם מים היינו מקבלים 8 גרם חמצן וגרם אחד מימן. נוכל לסכם את המשותף לכל תהליכי הפירוק בצורה הבאה:
מסת התרכובת = מסה כוללת של התוצרים
כיצד ניתן להסביר עובדות נסיוניות אלו בעזרה המבנה האטומי-מולקולרי?
במהלך פעולת פירוק התרכובת ניתקים קשרים בין אטומים הבונים את מולקולות התרכובת. האטומים, שהיו במולקולות התרכובת, נערכים בהרכב חדש, במולקולות חדשות, וכך נוצרים חומרים חדשים.
*246*
נוכל להדגים שינויים אלה בעזרת האיור הבא:
(בספר איור, היעזר במנחה)
תרכובת (מים) - פירוק - תוצרי פירוק (מימן)+ (חמצן)
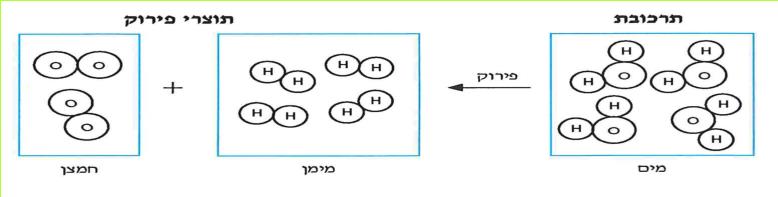
א. העתיקו למחברתכם את הטבלה הבאה והשלימו בה את החסר, על פי התרשים של פירוק המים לחמצן ולמימן.
(ריק) | התרכובת | התוצרים |
שם החומר | -- | -- |
מספר המולקולות | -- | -- |
המספר הכולל של האטומים | מימן חמצן | מימן חמצן |
ב. האם המספר הכולל של אטומי החמצן, שנתקבלו בתוצרים, שונה מהמספר הכולל של אטומי החמצן במולקולות התרכובת?
ג. האם חל שינוי במספר אטומי המימן במהלך תהליך הפירוק?
על פי תוצאות ניסוי כזה וניסויים רבים אחרים שנערכו, נקבע חוק "שימור האטומים".
חוק שימור האטומים: בכל תהליך כימי מספר האטומים מכל סוג נשאר קבוע. אטומים אינם נעלמים, ואטומים אינם נוצרים מעצמם.
*247*
ד. על פי הטבלה אנו רואים, כי לא חל שינוי במספר האטומים של היסודות שהשתתפו בתגובה. כלומר, מספרי האטומים השתמרו. למרות זאת חלו שינויים אחרים. מה הם?
ה. לו מדדנו את מסת התרכובת לפני תהליך הפירוק ואת מסת התוצרים אחר תהליך ההתרכבות, האם המסות היו שוות או שונות?
הסבירו את תשובתכם!
ו. האם חוק שימור המסה וחוק שימור האטומים סותרים זה את זה? הסבירו את תשובתכם!
*247*
חוק שימור האטומים חל גם על תהליכי התרכבות. נוכל להסביר זאת על פי המבנה האטומי-מולקולרי. בהסברנו נתייחס לתהליך, שבו המימן בוער. כידוע לכם, המימן מתרכב עם החמצן שבאוויר ונוצרים מים. התהליך הודגם בזמנו בניסוי "נר המימן".
בערת מימן בשפת האטומים
(בספר איור, היעזר במנחה)
חמצן + מימן - מים
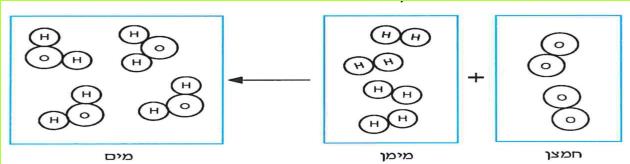
עיינו באיור של בערת מימן בשפת האטומים. האיור כבר מוכר לכם מתהליך פירוק המים. ואכן, תהליך בערת המימן הפוך לתהליך פירוק המים. נוכל לנסח זאת בעזרת התרשים הבא:
(היעזר במנחה)
מימן + חמצן (תגובה הפיכה) (התרכבות, פירוק) מים

מתוך עיון באיור של בערת המימן בשפת האטומים נראה, כי גס בתהליכי ההתרכבות מספרי האטומים נשמרים. חוק שימור המסה נובע מעובדת שימור האטומים, לכן נוכל לומר, שגם בתהליכי התרכבות המסה נשמרת.
*248*
לכלי זכוכית מרוקן מאוויר הוזרקו 8 גרם חמצן ו-1 גרם מימן. כאשר סגרו מעגל חשמלי, שהיה מחובר לכלי הזכוכית, התחמם חוט הלהט וגרם למימן ולחמצן להתרכב זה עם זה. כאשר נמדדה המסה של מערכת הניסוי נמצא, כי נוצרו 9 גרמים מים.
האם תוצאות אלו מאשרות את שימור המסה בתהליך התרכבות המימן עם החמצן? הסבירו את תשובתכם!
(בספר איור, היעזר במנחה)
נוכל לסכם את אשר למדנו בשיעור זה:
בתהליך הכימי ניתקים קשרים קיימים בין האטומים, ונוצרים קשרים חדשים. לכן המסה הכוללת אינה משתנה, כי במספר האטומים ובסוגיהם לא חל שום שינוי.
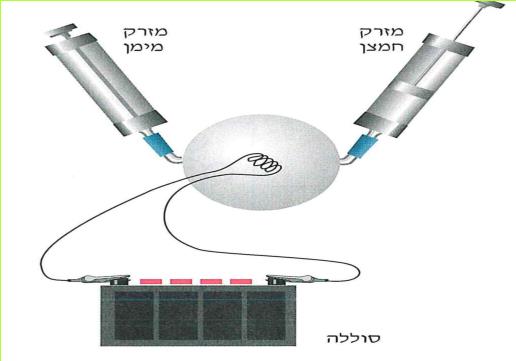
*249*
(בספר איורים, היעזר במנחה)
א. באיור א' נראים מאזניים במצב מאוזן: על כף אחת נר ועל כף שנייה מסה של 10 גרם. הניסוי לא נעשה במערכת סגורה.
1. לפניכם שלושה איורים (ב-ד). איזה מביניהם מציג בצורה נכונה את מצב המאזניים לאחר תום בערת הנר? נמקו!
2. האם תוצאות הניסוי סותרות את חוק שימור המסה? הסבירו!
3. נניח שהיו מניחים את הנר, המתואר בשאלה א, בכלי סגור, שיש בו חמצן לבערת הנר. איזה מבין שלושת האיורים (ב-ד) היה מתאר את תוצאות הניסוי. נמקו!
ב. האם האיור הבא מתאר בצורה נכונה את חוק שימור האטומים? נמקו!
-- מים - -- חמצן + -- מימן
*250*
*250*
א. בתהליך כימי, מסת התוצרים שווה תמיד למסת המגיבים.
ב. בתהליך כימי משתנה הרכב החומרים, אך המסה הכוללת נשמרת.
ג. מסת חומר הינה צירוף מסותיהם של האטומים, מהם מורכב החומר. לכן, אם מספר האטומים מכל יסוד המשתתף בתהליך נשמר, גם המסה נשמרת.
ד. בתהליך כימי ניתקים קשרים בין אטומים ונוצרים קשרים חדשים בין אטומים אחרים. במהלך שינויים אלה נשמר מספר האטומים מכל סוג.
*250*
א. הסבירו מהי מערכת סגורה.
ב. ניתן לאשר את חוק שימור המסה רק כאשר התהליכים מתרחשים במערכת סגורה. הסבירו מדוע.
ג. ציינו איזה משפט מהמשפטים הבאים שגוי, ומה שגוי בו?
1. בכל תהליך כימי נוצר חומר חדש.
2. מספר המולקולות של החומרים המגיבים שווה תמיד למספר המולקולות של התוצרים.
3. מספר האטומים של היסודות השונים לפני השינוי הכימי שווה למספר האטומים של היסודות השונים אחרי השינוי הכימי.
ד. לפניכם ניסוח כימי של התהליך הבא:
נחושת חמצנית (המגיב) - חמצן + (תוצרים) נחושת
1. כמה חומרים במגיב?
2. כמה חומרים נוצרו בתהליך זה?
3. האם בתהליך זה מתקיים חוק שימור המסה? הסבירו את תשובתכם!
*251*
*251*
בפרק ז', כשלמדתם על תהליכי הבערה, הכרתם קבוצת חומרים הנקראת תחמוצות. הנה לפניכם מספר תחמוצות כאלה:
התרכובת | נוסחת התחמוצת | שם התחמוצת |
מגנזיום חמצני | MgO | תחמוצת המגנזיום |
נחושת חמצנית | CuO | תחמוצת הנחושת |
פחמן דו חמצני | CO[2] | תחמוצת הפחמן |
מים | H[2]O | תחמוצת המימן |
גפרית דו חמצנית | SO[2] | תחמוצת הגפרית |
א. עיינו בנוסחה הכימית של התחמוצות. איזה יסוד מופיע בכולן?
התחמוצת הינה תרכובת בין היסוד חמצן ליסוד אחר.
יסוד + חמצן - תחמוצת
נהוג לחלק את התחמוצות לשתי קבוצות:
1. תחמוצות מתכתיות
2. תחמוצות אל-מתכתיות
תחמוצת מתכתית היא תרכובת של יסוד מתכתי עם חמצן.
תחמוצת אל מתכתית היא תרכובת של יסוד אל-מתכתי עם חמצן.
ב. העתיקו למחברתכם את הטבלה הבאה ורשמו במקום המתאים את שמות
התחמוצות, המופיעים בטבלה הקודמת בעמוד זה.
תחמוצת מתכתית | תחמוצת אל-מתכתית |
-- | -- |
*252*
ג. באילו טורים בטבלת היסודות (שבעמוד 206) נמצאים היסודות, שיוצרים תחמוצות אל-מתכתיות?
ובאילו טורים בטבלת היסודות נמצאים היסודות, שיוצרים תחמוצות מתכתיות?
*252*
כאשר תחמוצת אל-מתכתית מתרכבת עם מים, מתקבלת תרכובת חדשה הנקראת חומצה.
תחמוצת אל- מתכתית + מים - חומצה
השם חומצה בא מהמילה "חמוץ". מזונות שטעמם חמוץ מכילים חומצה.
החומצות מצויות לא רק בחומרי מזון אלא גם במוצרי תעשייה שונים, כמו בחלק מחומרי הניקוי.
זהירות: בין החומצות השונות יש גם חומצות שהן רעילות לאדם, ויש חומצות העשויות לגרום לפגיעה בעור ובבגדים.
(בספר תמונה, היעזר במנחה)

נשים כמות קטנה של אבקת גופרית בכף-בערה.
נדליק את הגופרית בעזרת להבת כוהליה או מבער גז.
את כף הבערה עם הגופרית הבוערת נכניס לתוך כוס זכוכית, המכילה מים עד כ-1/3 מנפחה. נכסה את הכוס בלוח זכוכית, כדי שהגז שנוצר לא יצא החוצה. הגז שנוצר בעת בערת הגופרית הוא גופרית דו חמצנית (SO[2]).
הגז גופרית דו-חמצנית מתמוסס היטב במים ויוצר אתם תרכובת חדשה - חומצה גופריתית.
גופרית דו-חמצנית + מים – חומצה גופריתית.
*253*
חומצה גופריתית היא חומצה חזקה המסוכנת לאדם. יש להימנע מלבוא עמה במגע.
חומצה אחרת, המוכרת לכם מחיי היום יום, היא מי-סודה. מי-סודה הם בעצם חומצה חלשה, הנקראת חומצה פחמתית. בשל היותה חלשה מאוד אין היא מסוכנת לאדם. בבתים רבים נהוג להכין מי-סודה בעזרת בקבוק "סיפולוקס" או "סודה סטרים".
(בספר תמונה, היעזר במנחה)

1. מאילו חומרים מכינים מי-סודה וכיצד?
2. במה דומה הכנת חומצה פחמתית להכנת חומצה גופריתית?
3. במה שונות שתי החומצות האלה?
בעבודה הקודמת הדגימו לפניכם כיצד נוצרת חומצה. אך כיצד נבדוק אם אכן היא נוצרה?
א. על המגש נמצאים מספר גבישים של חומצת לימון. חומצת לימון מצויה בלימון, בסוכריות חמוצות ובמשקאות קלים. המיסו את הגבישים במים. התמיסה שקיבלתם היא חומצת-לימון.
1. האם מראה התמיסה שונה מזה של המים?
2. כיצד נוכל לקבוע אם התמיסה שלפנינו הינה חומצית?
אמנם נכון שעל ידי טעימת התמיסה נוכל לגלות זאת. אך זכרו את כללי הזהירות. בדרך כלל אנו עוסקים בחומרים שאסור לטעמם. הכימאים גילו חומר המשנה את צבעו, כאשר הוא בא במגע עם חומצה. חומר זה נקרא לקמוס כחול.
*254*
ב. על המגש מספר ניירות לקמוס בצבע כחול. טבלו קיסם עץ בתמיסה של חומצת-לימון שהכנתם. הניחו את קצה הקיסם הרטוב על נייר הלקמוס.
מהו השינוי שחל בנייר הלקמוס?
ג. בכן המבחנות יש חמש מבחנות. המבחנות מסומנות באותיות א-ה.
בארבע מהן מצויות חומצות שונות:
חומצה כלורית, חומצת חומץ, חומצה חנקתית וחומצה גופריתית ובאחת מהן יש מים בלבד.
בדקו כל אחת מחמש המבחנות בעזרת נייר לקמוס.
1. באילו מן המבחנות השתנה צבע נייר הלקמוס לאדום?
2. איזו מבחנה הכילה מים? על סמך מה קבעתם זאת?
3. האם בעזרת הלקמוס יכולתם להבחין בין סוגי החומצות השונות? הסבירו את תשובתכם.
אנו כבר יודעים, כי הבדיקה לנוכחות חומצה נעשית בעזרת לקמוס כחול, בדרך הבאה:
לקמוס כחול + חומצה - לקמוס אדום
קחו דגימה מכל אחד מהחומרים הרשומים בטבלה הבאה, ובדקו איזה מהם מכיל חומצה. העתיקו את הטבלה למחברת ורשמו את התוצאות בטבלה. סמנו + במקום המתאים.
שמות החומרים | מכיל חומצה | לא מכיל חומצה |
סבון כביסה/ אבקת כביסה | -- | -- |
אשל (לבן) | -- | -- |
תמיסת סוכר | -- | -- |
תפוז | -- | -- |
מי-סודה | -- | -- |
עגבנייה | -- | -- |
סבון רחצה | -- | -- |
תמיסת "סודה לשתייה" | -- | -- |
משקה מוגז ממותק | -- | -- |
חומץ ביתי | -- | -- |
שמן | -- | -- |
*255*
(בספר תמונה, היעזר במנחה)
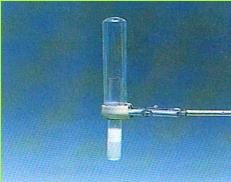
א. הכניסו למבחנה חומצה כלורית וחברו את המבחנה לכן.
ב. הוסיפו מספר חתיכות אבץ או חתיכת מגנזיום והתבוננו במתרחש במבחנה. במה אתם מבחינים?
ג. כסו את המבחנה במבחנה רחבה יותר (ראו תצלום). המתינו מספר דקות, הסירו את המבחנה העליונה וקרבו מיד גפרור דולק אל פתחה.
מה קרה?
לו חזרנו על ניסוי זה עם חומצות אחרות, היו מתקבלות אותן תוצאות, שראינו עם החומצה הכלורית. כלומר: (א) הופעת בועות גז; (ב) הופעת להבה.
הגז שנפלט במהלך התגובה בין המתכת לחומצה היה הגז מימן. אין במתכת אטומי מימן, מכאן שהמימן נפלט מהחומצה. ואכן, במולקולות של כל החומצות מצויים אטומי מימן. לפניכם רשימה קצרה של חומצות:
שם החומצה | נוסחתה |
חומצה כלורית | HCl |
חומצה גופרתית | H[2]SO[4] |
חומצה חנקתית | HNO[3] |
חומצה פחמתית | H[2]CO[3] |
חומצה זרחתית | H[3]PO[4] |
החומצות הן אלקטרוליטים. כלומר הן מתפרקות ליונים בהיותן בתמיסה מימית. תמיסותיהן המימיות מוליכות זרם חשמלי. היון השכיח בכל החומצות הוא יון המימן, H^+.
ד. מהו היסוד המופיע בכל החומצות?
ה. העתיקו למחברת את הקטע הבא והשלימו את החסר. המשותף לכל החומצות הוא:
1. טעמן ה- --.
2. משנות את צבע הלקמוס הכחול לצבע --.
3. תמיסותיהן מכילות את היון --.
4. תמיסותיהן המימיות -- זרם חשמלי.
*256*
ו. הכינו תרשים של מעגל חשמלי, שבו תמיסה מימית של חומצה מהווה חלק מהמעגל.
א. למדנו, כי כל החומצות מכילות את היסוד מימן, אך לא כל תרכובת המכילה את היסוד מימן הינה חומצה. כך למשל החומרים הבאים:
סוכר - C[6]H[12]O[6]
מים – H[2]O
כוהל – C[2]H[5]OH
כיצד ניתן לקבוע בדרך של ניסוי, כי חומרים אלה אינם חומצות?
ב. לכל אחד מהחומרים הבאים NO[2] ,SO[2] ,Na[2]O ,CuO הוסיפו מים וקיבלו תמיסות. אילו מהתמיסות הן חומצות?
ג. זיהוי חומצות בעזרת חומר אחר:
הכינו ארבע כוסות תה.
(בספר איור, היעזר במנחה)
לכוס אחת הוסיפו מספר טיפות חומץ ביתי.
לכוס שנייה הוסיפו מספר טיפות מיץ לימון.
לכוס שלישית הוסיפו מספר טיפות מים.
השוו את צבע התה בכוסות 1, 2, 3 לצבע התה בכוס הרביעית.
1. אילו חומרים בניסוי זה הם חומצות?
2. איזה חומר עזר לנו לגלות את החומצות? וכיצד?
3. מה תפקיד הכוס הרביעית?
*257*
*257*
בשיעור זה נכיר סוג נוסף של תרכובת, הנקראת בסיס. תרכובת זו מתקבלת, כאשר תחמוצת מתכתית מגיבה עם מים.
תחמוצת מתכתית + מים - בסיס
רבים מן הבסיסים הם רעלים, ומובן שאסור לטעום אותם.
(בספר תמונה, היעזר במנחה)
א. מלאו כרבע הכוס במים. הדליקו פס מגנזיום והחזיקו אותו מעל לפני המים, כך שהאבקה הלבנה הנוצרת במהלך הבערה תיפול למים שבכוס.
1. איזה חומר נוצר מבערת המגנזיום?
ב. בחשו את האבקה הלבנה שבמים. התמיסה שהתקבלה הינה בסיס. שמרו על התמיסה. תזדקקו לה בעבודה הבאה.
ניתן לסכם את השינויים, שהתרחשו בעבודה זו, בעזרת התרשימים הבאים:
א. חמצן + מגנזיום - תחמוצת המגנזיום
ב. מים + תחמוצת המגנזיום - בסיס המגנזיום
*258*
א. לפניכם תמיסה מהולה של בסיס הנתרן. טבלו נייר לקמוס כחול בתמיסה.
1. האם חל שינוי בצבע נייר הלקמוס?
2. טבלו נייר לקמוס אדום באותה התמיסה. מה קרה הפעם?
3. טבלו נייר לקמוס אדום בתמיסה של בסיס המגנזיום, שיצרתם בעבודה מ"ו. איזה שינוי חל בנייר?
4. האם שינוי זה מאשר את קביעתנו הקודמת, כי לפנינו בסיס? נמקו.
5 חזרו על הבדיקה עם נייר לקמוס אדום ובדקו את תגובתו בתמיסה מימית מהולה של בסיס אחר. מה קרה הפעם?
6. כיצד השתנה צבע נייר הלקמוס בשלושת החומרים שבדקתם?
7. כיצד מזהים בעזרת לקמוס אדום תמיסה מימית של בסיס?
א. קחו תמיסה מימית של החומרים הרשומים בטבלה הבאה ובדקו, איזה מהם מכיל בסיס?
(+ מכיל;- לא מכיל)
התמיסה הנבדקת | סבון להדחת כלים | אבקת כביסה | סבון רחצה | חלב | מיץ תפוזים | מים | אל-סבון (סבון לתינוקות) | שמפו |
מכילה בסיס | -- | -- | -- | -- | -- | -- | -- | -- |
לא מכילה בסיס | -- | -- | -- | -- | -- | -- | -- | -- |
בטבלה הבאה נוסחאות של בסיסים שאת שמותיהם הזכרנו בשיעורים האחרונים.
בנוסחאות של תרכובות אלה מופיע צמד היסודות OH. צמד יסודות זה מרמז לנו על בסיס, אך אין זה סימן מובהק. כדי להיות בטוחים בכך עלינו להיעזר בבדיקה עם נייר לקמוס אדום.
שם הבסיס | נוסחתו |
בסיס הנתרן | NaOH |
בסיס האשלגן | KOH |
בסיס המגנזיום | Mg(OH)[2] |
*259*
הבסיסים הינם אלקטרוליטים, ועל כן תמיסתם המימית מוליכה זרם חשמלי. היון המאפיין את מרבית. הבסיסים הוא: (OH)^-.
ב. באיזו מבין התכונות הבאות תבחרו כדי לזהות תמיסת בסיס? נמקו.
1. מוליכות חשמלית.
2. הפיכת לקמוס אדום ללקמוס כחול.
3. הפיכת לקמוס כחול ללקמוס אדום.
4. נוכחות יונים בתמיסה.
(בספר תמונה, היעזר במנחה)
א. לפניכם שורת מבחנות ובהן תמיסות שונות. לכל מבחנה מספר זיהוי.
בדקו בעזרת נייר לקמוס מתאים לאיזו מהקבוצות הבאות - חומצה, בסיס, תמיסה נייטרלית - משתייך כל אחד מהם.
העתיקו את הטבלה למחברתכם והשלימו בה את החסר. סמנו +, -, במקום המתאים.
השינוי בצבע נייר הלקמוס | מבחנה מס' 1 | מבחנה מס' 2 | מבחנה מס' 3 | מבחנה מס' 4 | מבחנה מס' 5 |
מכחול - לאדום | -- | -- | -- | -- | -- |
מאדום - לכחול | -- | -- | -- | -- | -- |
ב. השוו חומצה עם בסיס:
תכונות | חומצה | בסיס |
בנוסחה מופיעים היסודות: | -- | -- |
צבע נייר הלקמוס ה--משתנה ל-- | -- | -- |
*260*
*260*
ישנם מקרים, שפעולת החומצה אינה רצויה לנו. לדוגמה: אם נשארים שיירי מזון בין השיניים, הם מתפרקים ונוצרות חומצות. החומצות עלולות לגרום לעששת בשיניים. במשחת השיניים מצויים בסיסים הסותרים (מבטלים) את פעולתן המזיקה של החומצות.
(סותר = מבטל)
כיצד נעשה הדבר? כיצד הבסיס סותר את החומצה?
לפנינו שלוש כוסות.
בכוס א' תמיסה של בסיס הנתרן, בכוס ב' תמיסה של חומצה כלורית, כוס ג' ריקה.
א. נבדוק את הבסיס בעזרת נייר לקמוס אדום. מהו השינוי שחל בצבע?
ב. נבדוק את החומצה בעזרת נייר לקמוס כחול. מהו השינוי שחל בצבע?
ג. כעת נסתור את החומצה על ידי בסיס. נעביר כמחצית מתמיסת החומצה הכלורית לכוס הריקה.
נעביר גם כמחצית מתמיסת בסיס הנתרן לתוך הכוס הזו, ונערבב את שתי התמיסות.
נבדוק את התמיסה שהתקבלה בנייר לקמוס אדום, ואחר כך בנייר לקמוס כחול.
האם התמיסה חומצית או בסיסית? כיצד אתם יודעים זאת?
ד. אם התמיסה חומצית - נוסיף מספר טיפות בסיס.
אם התמיסה בסיסית - נוסיף מספר טיפות חומצה.
נבדוק את התמיסה בכל פעם בעזרת ניירות לקמוס.
נעשה זאת עד אשר צבע ניירות הלקמוס לא ישתנה עוד.

*261*
הבסיס והחומצה סתרו זה את זה. לפי מה קבענו זאת?
ה. נשאלת השאלה, מהו החומר שבכוס ג'?
יש לזכור, שבכל חומצה ישנו היון H^+, ובכל תמיסה מימית של בסיס ישנו היון (OH)^-.
האיורים שלמטה מסבירים איזה חומר נוצר, כאשר בסיס וחומצה סותרים זה את זה. אתם מכירים תרכובת זו. מה שמה?
(בספר שני איורים ושתי תמונות, היעזר במנחה)


ו. נוסף למים נוצרת עוד תרכובת. כדי לראותה עלינו להרחיק את המים. נעשה זאת על ידי אידוי המים מכמות קטנה של התמיסה. בתום פעולת חימום התמיסה והרחקת המים ממנה נותרת אבקה לבנה על קרקעית הכוס.
מהו החומר המופיע על קרקעית הכוס?
החומר NaCl נקרא נתרן כלורי, ושמו העממי מלח בישול.
ז. לפניכם איור ובו:
1. החומרים המשתתפים בתהליך הסתירה.
2. התוצרים המתקבלים בתהליך הסתירה.
עיינו באיור א' שלפניכם וציינו:
1. מה הם החומרים המשתתפים בתהליך הסתירה המוצג כאן?
2. מה הם תוצרי הסתירה?
ח. סוג המלח, הנוצר בסתירה, תלוי בסוג החומצה ובסוג הבסיס המשתתפים בתהליך הסתירה. על כן בתהליכי סתירה, שבהם משתתפים בסיסים שונים או חומצות שונות, נוצרים מלחים שונים. הנה דוגמה לתהליך סתירה נוסף:
השוו בין תהליך סתירה (א) לתהליך סתירה (ב).
1. האם המגיבים דומים או שונים? פרטו.
2. האם התוצרים דומים או שונים? פרטו.
3. איזה תוצר יופיע לדעתכם בכל תהליכי הסתירה? הסבירו מדוע!
*262*
המלח שנוצר בסתירה בין בסיס האשלגן לחומצה המלחית נקרא אשלגן כלורי. חומר זה אינו משמש כתבלין ואינו משמש לאכילה, אך משמש לייצור דשן יעיל וזול.
במילה "מלח" אנו מתכוונים בדרך כלל לתבלין המלוח החיוני, העולה על שולחננו. אך כפי שראיתם בפרק זה, כימאים מכנים בשם "מלח" קבוצה של תרכובות רבות שאינן מלוחות כלל, ולא כולן ראויות לאכילה. המשותף לתרכובות אלו - היותן מורכבות כולן מיסודות מתכתיים ויסודות אל- מתכתיים המחוברים יחד. תרכובות אלו מוצקות בתנאים הקיימים בחדר, וחלק גדול מהן מתמוסס במים בקלות.
במהלך הסתירה נפלט חום, כלומר תהליך הסתירה הוא אכסותרמי. ככל שהחומצה והבסיס מרוכזים יותר, התגובה ביניהם מלווה בשחרור חום רב יותר. לפעמים תגובה כזו אף עלולה להיות מסוכנת. לכן, אשר מערבבים חומצה עם בסיס, יש לעשות זאת בזהירות.
בהקשר לכך ניתן להעלות אירוע טרגי, שקרה במפעל תעשייתי במרכז הארץ, באירוע זה קיפח כבאי את חייו.
הכבאי הוזעק לטפל במאגר חומצה שהפריע לסביבה. הוא שפך כמות גדולה של בסיס מרוכז כדי לסתור את החומצה. כתוצאה מפעולה זו התהווה חום רב, שגרם להתאדות רבה של הנוזל בברכה ולהדף חזק, שנוצר מאדי הנוזל. הדף זה הפיל את הכבאי לברכת החומצה.
א. החומרים הבאים נמצאים בשימוש רב במשק הבית. קבעו מי מהם חומצה ומי בסיס, ואז הרכיבו מהם זוגות הסותרים זה את זה. סודה לשתייה, אבקת כביסה, חומץ, מי-סודה, סבון, לימון.
ב. חיים הלך לרופא והתלונן על צרבת וכאבים בקיבה. הרופא שלח את חיים לבדיקת מעבדה. במעבדה קבעו, שבקיבתו יש יותר מדי חומצה. הרופא הסביר לחיים: "הקיבה של כל אדם מכילה חומצה, העוזרת לפרק את חומרי המזון. אך עודף חומצה גורם לצרבת. זו הסיבה לכאבך." הרופא רשם לחיים מרשם לתרופה: סודה לשתייה. חיים שמע בעצת הרופא. בכל פעם שהרגיש צרבת - שתה כוס מים עם כפית סודה לשתייה, והצרבת עברה.
סודה לשתייה פועלת כבסיס, האם תוכלו להסביר כיצד עוזרת סודה לשתייה להקלת הצרבת?
*263*
ג. יש המבלבלים בין מי-סודה לסודה לשתייה. מי-סודה הינם חומצה, ואילו סודה לשתייה הינה בסיס.
כיצד ניתן להוכיח שמי-סודה אינם סודה לשתייה?
ד. יש אדמות חקלאיות, המכילות יותר מדי חומצה. באדמות "חמוצות" מדי אין הגידולים עולים יפה. איזה חומר צריך להוסיף לאדמה, כדי שלא תהיה "חמוצה"?
ה. כאשר חומצה מתרכבת עם בסיס, הם סותרים זה את זה ונוצרות שתי תרכובות חדשות. מהן?
העתיקו למחברת את התרשים הבא והשלימו בו את החסר:
בסי + חומצה - סתירה - -- + --
הרחבה פרק קריאה - ים המלח, ראו בעמודים 271-274.
*264*
*264*
תרכובות פחמן הן תרכובות המכילות את היסוד פחמן. תרכובות אלו הן מהנפוצות ביותר בטבע. כימאים מצאו, שמספר התרכובות השונות של הפחמן עולה על מספרן של כל התרכובות, המתקבלות משאר היסודות. תרכובות הפחמן כה נפוצות, עד כי נתקלים בהן בכל מקום. לדוגמה:
מזון - דבש, סוכר, חלב, שמן, חומץ, יין, קמח, בשר. בעצם, נתקלים בהן בכל "אבות המזון" - בפחמימות, בשומנים ובחלבונים.
(בספר איורים, היעזר במנחה)
*265*
לבוש - עור, צמר, פשתן ועוד.
ריהוט - עץ, פלסטיק ועוד.
תרופות - אספירין ועוד.
דלקים - נפט, בנזין, סולר, גז בישול ועוד.
תרכובות פחמן רבות, מצויות גם בגופנו וגם בגופם של שאר בעלי החיים ובצמחים.
בפרק זה נתמקד בשתי משפחות, שתרכובותיהן משמשות אותנו בחיי היומיום - הפחמימנים והכוהלים.
פחמימן הוא תרכובת, שהמולקולה שלה מורכבת מאטומי פחמן ומימן בלבד (פח - מימן = פחמן ומימן). הפחמימנים מצויים בטבע בעיקר בנפט גולמי, המכונה גם בשם "שמן האדמה", ובגז טבעי.
כידוע, אנו מפיקים אנרגיה מהפחמימנים על ידי תהליך בערה. כאשר הפחמימנים מגיבים עם חמצן הנמצא בעודף, נוצרים מים ופחמן דו-חמצני. האנרגיה המשתחררת משמשת לחימום, להפקת חשמל, להנעת מכונות וכו'.
חמצן + פחמימנים - בערה מלאה - חמצן + פחמן דו-חמצני + אנרגיה
הפחמימן הפשוט ביותר במבנהו ובהרכבו הוא המתאן.
מולקולת המתאן מורכבת מאטום פחמן אחד, שאליו קשורים ארבעה אטומי מימן. נוסחתו הכימית CH[4].
לפניכם צורות תיאור שונות של מולקולת מתאן.
(בספר נוסחת מבנה ודגם של מולקולת מתאן)
*266*
פחמימן מורכב יותר הוא האתאן. המולקולה שלו מורכבת משני אטומי פחמן, שלכל אחד מהם קשורים 3 אטומי מימן.
נוסחתו הכימית C[2]H[8].
(בספר נוסחת מבנה ודגם של מולקולת אתאן)

פחמימן אחר במשפחה זו הוא הפרופאן. המולקולה שלו מורכבת משלושה אטומי פחמן ומשמונה אטומי מימן.
נוסחתו הכימית C[3]H[8].
(בספר נוסחת מבנה ודגם של מולקולת פרופאן)
הדגמים של שלושת הפחמימנים שראינו, משקפים את אחת התכונות החשובות ביותר של אטומי הפחמן: יכולתם להתקשר זה אל זה וליצור שרשרות של אטומי פחמן.
(בספר איור, היעזר במנחה)
חלק מדגם של מולקולת פחמימן
*267*
הפחמימנים הם המרכיבים העיקריים של הנפט הגולמי. נפט גולמי הוא נוזל שחור-חום, צמיג ובעל ריח לא נעים. הנפט איננו תרכובת, אלא תערובת; תערובת זו מכילה עשרות רבות של תרכובות, בעיקר פחמימנים. בנפט הגולמי מצויים פחמימנים, כדוגמת המתאן והאתאן, יחד עם פחמימנים המכילים עד כ-60 אטומי פחמן במולקולה. מאחר שהנפט הגולמי הינו תערובת, החומרים שבו שומרים על תכונותיהם.
מדינת ישראל מיבאת נפט גולמי, וכאן מזקקים אותו, כלומר מפרידים אותו למרכיביו, בבתי הזיקוק בחיפה ובאשדוד.
*267*
זיקוק הוא תהליך שבו מפרידים נוזל מתמיסה. משתמשים בשיטת הפרדה זו, כאשר לנוזל המופרד יש טמפרטורת רתיחה שונה באופן בולט מנקודת הרתיחה של החומרים האחרים בתמיסה.
ההפרדה נעשית על ידי אידוי הנוזל מהתמיסה ועיבוי האדים לנוזל. הנוזל המתקבל בשיטת הזיקוק נקרא תזקיק.
פעולת הזיקוק איכה נחשבת לתהליך כימי, מכיוון שבמהלך תהליך הזיקוק ובסופו לא מתקבלים חומרים חדשים. אין פעולת הזיקוק גורמת לפירוק של חומר, אלא להפרדה בין החומרים המצויים בתערובת.
המטרה העיקרית בזיקוק של הנפט הגולמי הינה להפריד בין מרכיביו בהתאם לנקודת הרתיחה שלהם.
מטרה נוספת היא להרחיק מתוכו חומרים זרים שאינם פחמימנים. החומרים הזרים עלולים להזיק בזמן השימוש במוצריו של הנפט הגולמי.
נפט גולמי, שהורחקו ממנו מים ומלח, מועבר דרך צינורות המחוממים לטמפרטורה של כ-400 מעלות צלזיוס. בצאתו מהתנור, הנפט הגולמי מועבר למגדל מפריט, הנקרא גם מגדל זיקוק. [מפריט - מלשון הפרטה, לפרוט לפרטים.]
במגדל הזיקוק מתאדה חלק מהנפט הגולמי, והחלק הנשאר שוקע לתחתית המגדל. האדים עולים במגדל ובאים במגע עם הנוזלים שבצלחות העיבוי, ומתעבים בהם בהתאם לטמפרטורת העיבוי שלהם. ככל שהקומה במגדל גבוהה יותר - מתעבה בה פירטה שנקודת רתיחתה נמוכה יותר. (פירטה - קבוצה של פחמימנים שונים המתעבים באותה צלחת עיבוי.)
בכל צלחת עיבוי מצוי נוזל אחר בעל טמפרטורת עיבוי אופיינית. האדים של החומרים בעלי טמפרטורות הרתיחה הנמוכות ביותר מגיעים לראש המגדל. אלה הם הפחמימנים, שמהם עשוי גז הבישול.
*268*
(בספר תמונה, היעזר במנחה)
- צינור המוביל גז בישול מעובה למאגר האיחסון
- צינור המוביל בנזין
- צינור המוביל נפטא
- צינור המוביל סולר
- ארובה

*269*
(בספר איור, היעזר במנחה)
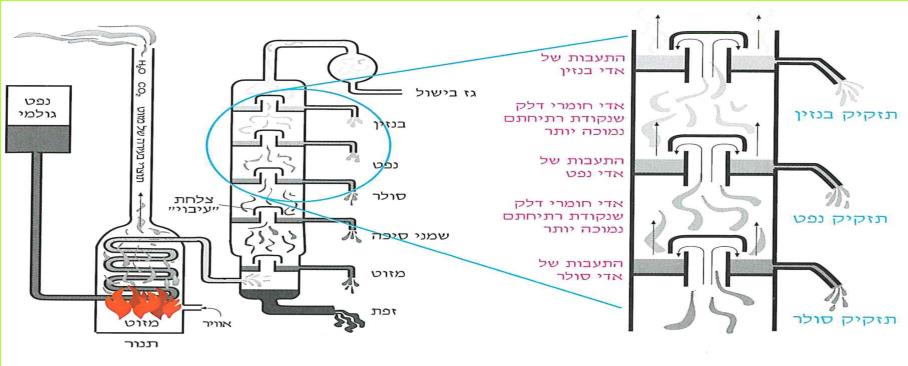
רשימת הפירטות המתקבלות מזיקוק נפט גולמי.
תחום טמפרטורת הרתיחה(במעלות צלזיוס) | שם הפירטה - תערובת פחמימנים | מספר אטומי הפחמן במולקולות החומרים המצויים בפירטה |
למטה מ-0 מעלות צלזיוס | גז בישול | C[1]-C[4] |
35-205 | בנזין למכוניות | C[5]-C[12] |
180-279 | קרוסין - דלק מטוסים | C[10]-C[16] |
260-370 | סולר - דלק למנועי דיזל | C[19]-C[35] |
350-470 | חומרי סיכה - וזלין | C[36]-C90 |
*270*
(בספר שני איורים, היעזר במנחה)
החלק היחסי של מרכיבי הנפט בנפט גולמי
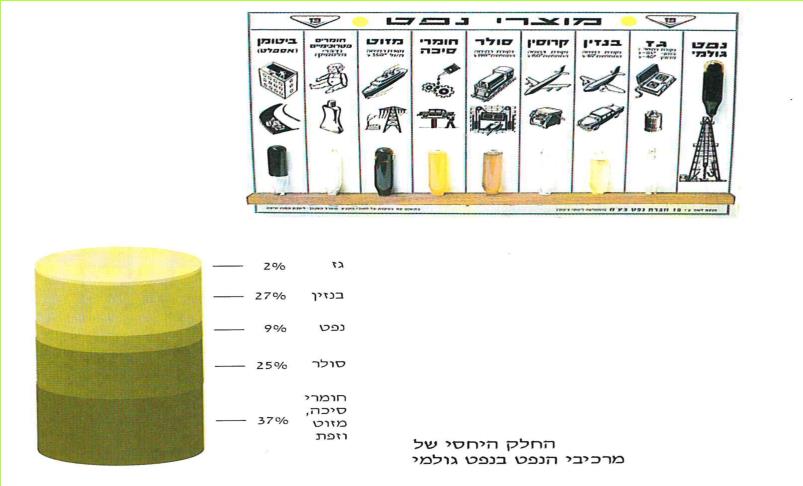
חומרי סיכה, מזוט וזפת - 37%
סולר - 25%
נפט - 9%
בנזין - 27%
גז - 2%
עיינו באיור של בית הזיקוק ובטבלה וענו על השאלות הבאות:
א. מהו התפקיד של תנור החימום בבית הזיקוק?
ב. מדוע יש צורך באספקת אוויר לתנור החימום?
ג. מה קורה לאדי הנפט הגולמי, המגיעים למגדל הזיקוק?
ד. איזו קבוצה של פחמימנים מתעבה ראשונה במגדל הזיקוק? הסבירו מדוע!
ה. האם עיבוי הוא תהליך כימי? הסבירו!
ו. מדוע נקרא מגדל הזיקוק גם בשם מגדל מפריט?
הרחבה: פרק קריאה - אורך השרשרת הפחמימנית ותכונותיה, ראו עמ' 275-276.
*271*
*271*
מי הירדן והמעיינות הנשפכים לים המלח ממיסים בדרכם מלחים רבים. מלחים אלה נשארים בים המלח בשל היותו אגם סגור.
(בספר תמונה, היעזר במנחה)

*272*
הטמפרטורה הגבוהה והלחות היחסית הנמוכה השוררים באזור ברוב ימות השנה גורמים לאידוי רב של מים. גורמים אלה מסבירים את הריכוז הגדול של מלחים, ריכוז שהקנה לאגם זה את שמו: "ים המלח".
מי ים המלח מלוחים בערך פי עשרה מכל ים אחר בעולם. הריכוז הרב של מלחים מומסים גורם לצפיפות הגדולה של המים בים המלח. כלומר, ליטר מים מים המלח כבד יותר מליטר מי ברז. לכן אנו יכולים לצוף על פני ים המלח, גם אם איננו חוגרים מצופים.
לחלק מהמלחים המומסים בים המלח יש תכונות מרפא חשובות. נוסף לחשיבותו של ים המלח כאתר נופש ומרפא, הוא גם המקור העיקרי לחומרי גלם בארצנו.
שני החומרים העיקריים המופקים מים המלח הם האשלג והברום. האשלג הוא המלח אשלגן כלורי (KC1), שהוא דשן עשיר באשלגן. האשלגן הוא אחד היסודות הדרושים לצמח בכמויות גדולות. האשלגן איננו מגיע לצמח כאטומים נייטרליים של אשלגן, אלא כיונים חיוביים. מקורם בתרכובת KCl שהתמוססה במי הקרקע והתפרקה ליוני כלור שליליים וליוני אשלגן חיוביים.
*273*
(בספר תמונה): מפעל האשלג

*274*
הברום מופק ממלחים המכילים אותו, בעיקר ממגנזיום ברומי MgBr[2])). הברום משמש להכנת חומרי הדברה, חומרי צילום, תרופות ולתעשיית הדלק. הוספתו לחומרים פלסטיים מקנה להם תכונה של "מעכב בערה". החומר הפלסטי הופך לחומר לא דליק, דבר חשוב במקרה של שרפה.
רוב האשלג והברום המופקים מים המלח מיוצאים לחוץ לארץ. מדינת ישראל היא יצרן הברום השני בגודלו בעולם (לאחר ארה"ב).
אחת מתרכובות הברום, שאותה מייצרים בכמויות גדולות במפעלי ים המלח, נקראת מתיל ברומי. תרכובת זו משמשת להכנת חומרי הדברה וכתוספת לדלק. לאחרונה עלה החשש שהתרכובת מתיל ברומי עלולה לגרום לבעיות אקולוגיות.
- אשלג: לתעשיית דשנים בארץ (ליצוא)
- כלור: להפקת ברום מתרכובות ברום לחיטוי בריכות שחיה כחומר גלם לייצור חומרי ניקוי.
- ברום: לתרכובות ברום כמו אתילן - דו ברומי (ליצוא).
- מלחי אמבטיה: למרפא (ליצוא).
- מגנזיום (ליצוא).
- תמיסות של תרכובות מגנזיום: לייצור לבנים חסינות מאש.
- מלח בישול: לתעשיה הכימית מלח שולחני (ליצוא).
1. מניין מגיעים המלחים הרבים לים המלח?
2. מדוע ריכוז המלחים בים המלח גבוה מזה שבים התיכון?
3. מהו האשלג ולמה הוא משמש?
4. מאיזה מלח מפיקים את הברום? למה משמש הברום?
*275*
*275*
אנו כבר יודעים, כי אטומי הפחמן יכולים להתקשר זה אל זה וליצור שרשרות פחמן באורך שונה. אורך השרשרת נקבע, בין היתר, על ידי מספר אטומי הפחמן הנקשרים זה אל זה. אם נערוך את הפחמימנים השונים, הנמנים עם אותה משפחה, על פי אורך השרשרת, נראה שבראש השורה יופיע המתאן. הפחמימנים האחרים יהיו מסודרים בזה אחר זה בהתאם למספר אטומי הפחמן שבהם. השני ברשימה יהיה האתאן עם שני אטומי פחמן, השלישי יהיה הפרופאן עם שלושה אטומי פחמן, וכן הלאה.
שם הפחמימן | הנוסחה | נקודת הרתיחה(במעלות צלזיוס) |
מתאן | CH[4] | -162 |
אתאן | C[2]H[6] | -89 |
פרופאן | C[3]H[8] | -42 |
בוטאן | C[4]H[10] | -0.5 |
פנטאן | C[5]H[12] | 36 |
הקסאן | C[6]H[14] | 69 |
הפטאן | C[7]H[16] | 98 |
אוקטאן | C[8]H[18] | 126 |
נונאן | C[9]H[20] | 151 |
דקאן | C[10]H[22] | 174 |
אם תתבוננו באיורים של שורת פחמימנים זאת תוכלו לראות, כי כל פחמימן שונה מקודמו בשורה - באטום פחמן אחד ובשני אטומי מימן.
(בספר שני איורים, היעזר במנחה)
א. מתאן
ב. אתאן
*276*
(בספר שני איורים, היעזר במנחה)
- פרופאן
- בוטאן
א. כמה פחמימנים נוספים ניתן להכניס בין הבוטאן לבין האוקטאן?
תוספת זו של אטום פחמן ושני אטומי מימן משפיעה לא רק על אורך השרשרת של מולקולת הפחמימן אלא גם על טמפרטורת הרתיחה של החומר. נמצא, כי ככל שהמולקולה של הפחמימן ארוכה יותר, כן גבוהה יותר טמפרטורת הרתיחה של החומר (לא של מולקולה בודדת כמובן אלא של ציבור גדול מאוד של מולקולות).
ב. עיינו בטבלה שבעמוד הקודם והשיבו על השאלות הבאות.
1. טמפרטורת החדר נעה בין 15 מעלות צלזיוס ל-25 מעלות צלזיוס. אילו מהפחמימנים יימצאו בטמפרטורת החדר במצב גזי? נמקו!
2. עיינו עתה גם בתרשים של בית הזיקוק בעמוד 269 ונסו לקבוע איזו קבוצה של פחמימנים תתאדה ראשונה, ומדוע. בססו את נימוקכם על פי נתוני הטבלה!
3. ידוע, כי ככל שטמפרטורת הרתיחה של הנוזל גבוהה יותר - החומר יותר צמיג-סמיך (זורם לאט יותר).
אילו מבין החומרים המופיעים בטבלה של מרכיבי הנפט הגולמי, הם נוזלים סמיכים?
4. חומרים בעלי צמיגות רבה מאוד יכולים לשמש כשמני סיכה. הסבירו מדוע שמני הסיכה מתקבלים בחלק התחתון של מגדל הזיקוק.
*277*
*277*
למדנו על תרכובות פחמן המורכבות מהיסודות פחמן ומימן בלבד - פחמימנים (פחמן + מימן).
נכיר קבוצה נוספת של תרכובות פחמן. קבוצה זו נקראת כוהלים.
בטבלה הבאה מספר כוהלים:
שם הכוהל | נוסחתו | תיאור מבנה מולקולה אחת(היעזר במנחה) |
מתאנול | CH[3]OH | |
אתאנול | C[2]H[5]OH | |
פרופאנול | C[3]H[7]OH |
א. איזה יסוד מצוי במשפחה זו נוסף ליסודות המצויים בפחמימנים?
מעיון בנוסחות של הכוהלים בטבלה אפשר לראות, כי מצויה קבוצת אטומים המופיעה בכל הכוהלים. קבוצה זו היא קבוצת (OH).
באחד מהשיעורים הקודמים עסקנו בקבוצת חומרים, שגם תרכובותיה הכילו קבוצה זו של יסודות (OH).
ב. מה שם הקבוצה? רשמו נוסחה של תרכובת אחת.
א. ניתן לבדוק זאת בשתי דרכים. מהן?
ב. בקשו מהמורה את הכלים והחומרים המתאימים לאחת הבדיקות.
1. כתבו את ממצאי בדיקתכם במחברת!
2. מהי מסקנתכם מהבדיקה?
ודאי תשאלו, מהי הסיבה להבדל בתגובות של הבסיס ושל הכוהל? שהרי בשתי התרכובות מצויה הקבוצה OH. הסיבה לכך היא שהבסיס NaOH הוא אלקטרוליט והוא מתפרק בתמיסה ליוני ( OH^- וליוני Na^+.
לעומת זאת מולקולות הכוהל אינן מתפרקות ליונים בתמיסה.
*278*
הכוהל הוא נוזל, חסר צבע, בעל ריח חריף, דליק ונדיף (מתאדה במהירות). בשל היותו חומר דליק הוא יכול לשמש כחומר דלק, כמו בכוהליה שבתצלום.
(בספר תמונה, היעזר במנחה)

קיימים סוגים רבים של כוהל, נדון באחד מהם, זה המתקבל בתהליך תסיסה של ענבים. דורכים ענבים ומניחים אותם בכלי סגור. פטריות המכונות שמרי יין, הנמצאות בין היתר גם על קליפות הענבים, מפרקות חלק מכמות הסוכר שבמיץ הענבים. פירוק זה נקרא תסיסה. תוצרי התסיסה הם כוהל ופחמן דו חמצני. עם פתיחת הכלי, הפחמן הדו חמצני נפלט כגז ונותרים בכלי כוהל, סוכר ומים המהווים יחד את היין.
(בספר תמונה, היעזר במנחה)

א. האם, לדעתכם, ניתן להכין "נר" מיין בדומה לנר כוהל, שהכרתם מלימודיכם בשנה שעברה? נמקו!
ב. המורה יערוך את הניסוי. רשמו את תצפיותיכם ומסקנותיכם.
*279*
*279*
הכוהל נקרא בלועזית אלכוהול והוא מצוי במשקאות חריפים, ביין ובבירה לבנה. הוא נספג במחזור הדם במהירות רבה, ובאמצעותו הוא מגיע לכל חלקי הגוף. ההשפעה הבולטת ביותר של הכוהל היא על מערכת העצבים. אולם הוא משפיע גם על מערכות גופניות אחרות, כגון: הכבד, הלבלב, מערכת העיכול, כלי הדם והלב. שתייה מוגזמת וממושכת עלולה לגרום למחלות שונות.
בניגוד לדעה הנפוצה בקרב רבים הכוהל אינו משקה מעורר. לאמיתו של דבר, הוא חומר המדכא את פעילותה של מערכת העצבים. התחושות הראשוניות של ערנות ושל מצב-רוח מרומם מקורן בהשפעתו המדכאת על מרכזים במוח, המפקחים על תהליכי החשיבה והשיפוט ועל ההתנהגות. עם חדירת הכוהל למוח נפגמת החשיבה, פוחתת מהימנות השיפוט, הרגשות נעשים שטחיים יותר וההתנהגות פחות מבוקרת. תופעות אלה עשויות להעניק לאדם תחושות של ערנות וביטחון. ככל שגדלות כמויות הכוהל מתגלות בעיות בשווי המשקל ובתנועה במרחב.
הכוהל המצוי במשקאות חריפים, ביין ובבירה לבנה נקרא אתאנול.
כוהל אחר הנקרא מתאנול, משמש כחומר דלק. המתאנול הוא רעל מסוכן, היכול לגרום לעיוורון ולמוות.
*280*
*280*
הפולימרים הם חומרים הבנויים ממולקולות ענק שהן מולקולות בעלות אורך רב. חומרים רבים הם פולימרים. כיצד נבנות מולקולות ענק? המולקולה הפשוטה שממנה נוצרת מולקולת ענק נקראת מונומר (ביוונית מונו = אחד, קר = יחידת מבנה).
כאשר יחידות מבנה קטנות ורבות מתקשרות אחת לשנייה בסדר מסוים, מתקבלת מולקולת ענק - פולימר (פולי = הרבה).
לתהליך, שבו מתקשרות מולקולות קטנות רבות לשרשרת ארוכה, קוראים בשם פילמור. תהליך הפילמור מתרחש בטבע בגופם של הצמחים ובגופם של בעלי חיים. לדוגמה: מולקולות של הסוכר גלוקוז הנוצרות בתהליך ההטמעה, מתקשרות אחת לשנייה ונעשות למולקולות ענק של עמילן. מולקולה אחת של עמילן יכולה להיות מורכבת מ-500 עד 10,000 מולקולות של גלוקוז.
(בספר איור, היעזר במנחה)
מונומרים של גלוקוז - פילמור - קטע ממולקולת עמילן (פולימור)
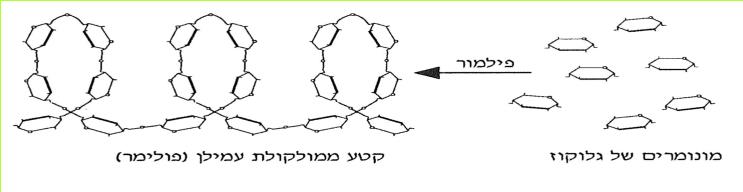
הגלוקוז נקרא גם בשם סוכר ענבים. מתיקותו פחותה משל הסוכר סוכרוז, שבו אנו משתמשים יום יום. הגלוקוז הוא מוצק גבישי לבן, מסיס במים.
העמילן הוא פולימר של גלוקוז. העמילן חסר טעם ואינו נמס במים. העמילן מצוי בריכוזים גדולים בזרעים של חיטה, אורז, תירס ובפקעות של תפוחי אדמה. פולימרים אחרים הנמצאים בטבע הם: סיבי כותנה (צמר גפן), משי וגומי שמקורו מעץ הגומי. בימינו, רוב החומרים הבנויים ממולקולות ענק הם חומרים מלאכותיים, פרי תכנון הכימאי.
חומר מלאכותי נקרא גם חומר "סינתטי", כלומר חומר שנוצר בידי האדם בעזרת תהליכים כימיים. מבין החומרים הסינתטיים השונים המיוצרים כיום, מוכרת לכם קבוצת החומרים הפלסטיים. אלה חומרים שניתן לעצב את צורתם בקלות במהלך יצורם, ולכן נקראו בשם "חומר פלסטי" (פלסטי = ניתן לשנות את צורתו). בסוף תהליך הייצור מתקשים חומרי הפלסטיק וצורתם נשמרת.
*281*
אם תביטו בסביבתכם: בבית, ברחוב ובשדה תגלו, כי כלים ומכשירים רבים עשויים מחומרים פלסטיים שהם פולימרים.
(בספר 9 איורים, היעזר במנחה)

*282*
בבדים רבים הסיבים הפולימריים הסינתטיים הם החלק העיקרי של הבד, למשל: קרילן, דיאולן, דקרון, פוליאסטר.
(בספר תמונה, היעזר במנחה)

הניילון הוא פולימר סינתטי. מחוטי ניילון מכינים גרביונים וחוטים לחכות דיג ולרשתות דיג. בעבודה הבאה ניצור חוט ניילון.
א. לפניכם שני בקבוקונים ובכל אחד מהם תמיסה אחרת. לחומר המצוי בבקבוק מס 1 נקרא חומר א', ולחומר שבבקבוק מס 2 נקרא בשם חומר ב'.
(בספר תמונה, היעזר במנחה)

ב. לתוך כלי ההדגמה נשפוך את חומר א'.
לאחר מכן נשפוך בזהירות ובאיטיות את חומר ב' מעל חומר א', הנמצא כבר בכלי התגובה.
*283*
התמיסות אינן מתערבבות. נוצרות שתי שכבות נפרדות.
בשטח המגע בין שתי השכבות נוצרת שכבה דקה של ניילון.
(בספר איור, היעזר במנחה)
ג. בעזרת מלקטת נתפוס את הניילון שבמרכז השכבה שנוצרה, ונמשוך את המלקטת לאט כלפי מעלה. נלפף את קצה חוט הניילון סביב המלקטת ונמשיך בכך, עד שהחומרים שבכלי התגובה ייגמרו.
ד. נשטוף את חוט הניילון שיצרנו במים זורמים. אם נרצה נוכל אף למדוד את אורכו.
(בספר תמונה, היעזר במנחה)
*284*
כיצד נסביר את יצירת הניילון?
החומרים א' ו-ב' הם שני מונומרים שונים. בגבול שבין שני החומרים האלה נוצרה תרכובת. התרכובת עשויה מיחידות מבנה של חומר א וחומר ב, הקשורות זו בזו חליפות. בדרך זו מתקבלת שרשרת ארוכה של היחידות החוזרות - מתקבל הפולימר ניילון.
(בספר שני איורים, היעזר במנחה)
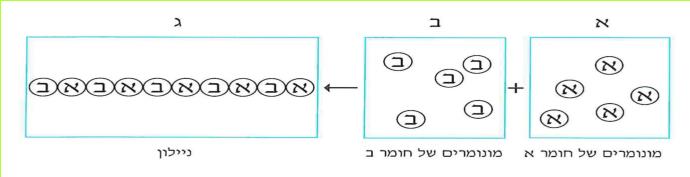
א. כתבו שמות של ארבעה פולימרים טבעיים.
ב. מדוע הניילון נחשב לפולימר?
ג. כתבו בלשונכם את המשפט הבא: "החומרים הפלסטיים הינם פולימרים סינתטיים".
ד. האם הניילון הוא תערובת של מונומרים, או שהוא תרכובת? נמקו!
*285*
*285*
כידוע לכם, עמילן הוא פולימר של הסוכר גלוקוז. במילים אחרות, מולקולות עמילן בנויות ממולקולות רבות של גלוקוז הקשורות זו לזו. אף שהגלוקוז הוא בעל דרגת מתיקות נמוכה והעמילן חסר כל מתיקות, הצליחו לייצר מהעמילן המפורק חומר ממתיק, הנקרא בשם תרכיז ממתיק. כיצד מכינים נוזל מתוק מאוד מאבקת עמילן, שאינה מתוקה כלל?
מאחר שמיץ הענבים הוא חומר גלם יקר מכדי להפיק ממנו גלוקוז, מייצרים את הגלוקוז מפירוק עמילן, הפולימר שלו.
עמילן (פולימר) - גלוקוז (מונומר)
בעזרת תהליך כימי מסוים ניתן להפוך את מולקולת הגלוקוז למולקולה של סוכר הנקרא פרוקטוז. הפרוקטוז מתוק כפליים מסוכר הגלוקוז. לגלוקוז המתקבל מוסיפים חומר (אנזים), המסייע להפיכת גלוקוז לסוכר פרוקטוז.
גלוקוז - אנזים - פרוקטוז
בשלב זה מוסיפים חומרי טעם וצבע מאכל, המעניקים לתרכיז מראה מושך יותר.
*285*
א. תחמוצת היא תרכובת של יסוד עם חמצן.
ב. תחמוצת המורכבת מיסוד מתכתי נקראת תחמוצת מתכתית. תחמוצת המורכבת מיסוד אל-מתכתי נקראת תחמוצת אל-מתכתית.
ג. תמיסה מימית של תחמוצת מתכתית יוצרת בסיס, תמיסה מימית של תחמוצת אל-מתכתית יוצרת חומצה.
ד. נייר לקמוס כחול מאדים בתמיסה חומצית. נייר לקמוס אדום מכחיל בתמיסה בסיסית.
ה. בכל תמיסה מימית של חומצה מצוי היון H^+. בכל תמיסה מימית של בסיס מצוי היון (OH)^-.
*286*
ו. מתכת הטבולה בתמיסה מימית של חומצה גורמת לפליטת מימן מהתמיסה החומצית.
ז. תרכובות כגון בסיסים או חומצות מצויות בחומרי ניקוי ובחומרי טבע, כמו בפירות ובירקות.
ט. חומצה יכולה לבטל את פעולת הבסיס, ובסיס יכול לבטל את פעולת החומצה. פעולת הביטול ההדדית בין חומצה לבסיס נקראת סתירה.
י. בתגובת סתירה נוצרים מים ומלח.
*286*
יא. פחמימנים הינם תרכובות של פחמן ומימן בלבד. המגוון הרב של הפחמימנים נוצר בגלל יכולתו של אטום הפחמן להתקשר לאטומי פחמן נוספים.
יב. המולקולות של הפחמימנים הן בצורת שרשרת. לחלק מהן השרשרות קצרות ולחלקן הן ארוכות.
יג. הכוהלים הם תרכובות פחמן המורכבות מהיסודות פחמן, מימן וחמצן, שבהן מופיעים היסודות, מימן וחמצן כצמד (OH).
למשל: C[2]H[5]OH ,CH[3]OH.
יד. פולימרים הינם תרכובות הבנויות ממולקולות ענק. מולקולת ענק בנויה ממספר רב של מולקולות קטנות. למולקולה קטנה, שיחד עם רבות מחברותיה מרכיבה מולקולת ענק, קוראים מתומר. למולקולת הענק קוראים פולימר.
טו. חומרים סינתטיים רבים בנויים מפולימרים. למשל: ניילון, פלסטיק. גם בטבע קיימים פולימרים, למשל: עמילן, משי, כותנה, גומי ואף חלבון ביצה.
*286*
(הערה: תלמידים שלא למדו את פרקי ההרחבה לא יענו על שאלות א, ט, י.) להלן רשימה של תרכובות שונות: MgO SO[2] ,NO[2] ,CO[2] ,H[2]O, גז בישול, ניילון, פלסטיק, CaO ,CH, ,KCl, בנזין, CuO, תמיסות מימיות של: NaCl ,NaOH, CH[3]OH ,HCI, משי, גומי טבעי, גומי מלאכותי, דיאולן, עמילן.
א. העתיקו את הטבלה הבאה למחברת. רשמו בטבלה במקום המתאים כל אחת מהתרכובות המופיעות ברשימה.
פולימר | תחמוצת | בסיס | חומצה | מלח | פחמימן | כוהל |
*287*
ב. באילו מבין התמיסות המימיות של החומרים המופיעים ברשימה יהפוך נייר לקמוס אדום לכחול?
ג. באילו מבין התמיסות המימיות של החומרים המופיעים ברשימה יהפוך נייר לקמוס כחול לאדום?
ד. אילו מבין החומרים הללו יגיבו ביניהם בתגובת סתירה?
ה. מה הן התכונות המשותפות לכל החומצות?
ו. מה הן התכונות המשותפות לכל הבסיסים?
ז. ערבבו חומצה עם בסיס. כשבדקו את תערובת התמיסות עם נייר לקמוס כחול, הנייר לא שינה את צבעו. האם ניתן ללמוד מכאן כי תערובת התמיסות הינה נייטרלית? נמקו!
ח. כאשר מכניסים נייר לקמוס אדום למים הוא נשאר אדום.
כאשר מכניסים נייר לקמוס אדום לחומצה הוא נשאר אדום. האם נכון אפוא לקבוע, שהמים הם חומצה? מדוע?
ט. מהו פולימר?
י. האם כל פולימר הוא חומר סינתטי?
יא. הפחמימנים מורכבים משני יסודות. מה הם?
יב. מהי התכונה המשותפת לתחמוצות מתכתיות ולתחמוצות אל-מתכתיות?
*288*
*288*
החלקיק הקטן ביותר ביסוד.
אטום בנוי מפרוטונים ונייטרונים המהווים את הגרעין, ומאלקטרונים הנעים במרחב האטום.
(א- טום מיונית: לא ניתן לחלוקה) (ראו יסוד).
אטום שבו מספר האלקטרונים שווה למספר הפרוטונים.
יסוד שאין לו תכונות של מתכת, כגון: הולכת זרם חשמלי.
מוט העשוי מחומר מוליך ומחובר לאחד ההדקים של מקור זרם.
אלקטרודה המחוברת להדק החיובי של מקור זרם חשמלי.
אלקטרודה המחוברת להדק השלילי של מקור זרם חשמלי.
פירוק כימי של חומר על ידי זרם חשמלי (ביוונית אלקטרו = חשמל, ליזיס = פירוק) (ראו פירוק כימי).
חומר שתמיסתו המימית מוליכה זרם חשמלי.
חלקיק באטום בעל מטען חשמלי שלילי הנמצא בתנועה מתמדת (ראו אטום).
אלקטרון אשר נמשך אל גרעין האטום בכוחות חלשים יחסית לשאר האלקטרונים, ולכן חופשי לנוע מאטום לאטום.
*11*
יחידה שבה נמדד הזרם החשמלי.
ראו מד זרם.
חומר המשנה את צבעו רק בנוכחותו של חומר מסוים. האינדיקטור משמש אמצעי לזיהוי חומרים, שזהותם אינה ידועה.
חומר שתמיסתו המימית מכילה את היון (OH)^-. תמיסת הבסיס הופכת נייר לקמוס אדום לכחול.
התרכבות של חומר עם חמצן (הבערה מלווה בפליטת חום).
בערה לא שלמה, שבה מסוגלים חלק מן התוצרים להמשיך ולהתרכב עם חמצן.
בערה שבה התוצרים אינם יכולים להמשיך ולהתרכב עם חמצן.
גוף שבו מספר האלקטרונים קטן ממספר הפרוטונים או גדול מהם.
גוף שיש בו מחסור באלקטרונים ביחס למספר הפרוטונים.
גוף שיש בו עודף של אלקטרונים ביחס למספר הפרוטונים.
גוף שאינו טעון, גוף שבו מספר הפרוטונים שווה למספר האלקטרונים.
*290*
משפחה של יסודות שכולם גזים בטמפרטורת החדר. חלקם חסרי פעילות כימית, ולשאר - פעילות כימית נמוכה ביותר. הם מופיעים בטבע במולקולות חד-אטומיות. עם משפחה זו נמנים היסודות: הליום, ניאון, ארגון, קריפטון וכסנון.
ראה מחולל זרם.
אותו חלק מהאטום הנמצא במרכז. בנוי מפרוטונים ונייטרונים. הגרעין טעון מטען חשמלי חיובי. לגרעין נפח קטן ביותר ביחס לנפח של האטום כולו.
ראה מחולל זרם.
משפחה של יסודות אל-מתכתיים שלחלקם פעילות כימית גבוהה. נוטים ליצור מלחים - תרכובות עם מתכות.
חיבור גוף של מכשיר חשמלי במוליך לאדמה כאמצעי ביטחון נגד פגיעה, העלולה להיגרם ממגע במכשיר מחשמל. ההארקה אינה הגנה מספקת מפני התחשמלות.
נקודת חיבור של סוללה למעגל חשמלי. לכל סוללה שני הדקים.
הדק חיובי - נקודת חיבור שיש בה חוסר באלקטרונים.
הדק שלילי - נקודת חיבור שיש בה עודף באלקטרונים.
מעבר זרם בעל עוצמה מסוכנת דרך גוף האדם.
תכונה של חומר המציינת את מידת התנגדותו למעבר אלקטרונים דרכו. (ככל שהתנגדותו של חומר גדולה יותר, כך מוליכותו של החומר קטנה יותר.)
יצירת קשרים בין אטומים של יסודות שונים.
*291*
תנועה של אלקטרונים הנעים בכיוון אחד במוליך, או תנועה של יונים הנעיס בתמיסה מימית.
חומר שתמיסתו המימית מכילה יוני H^+ והופכת נייר לקמוס כחול לאדום.
בתהליך כימי מספרם של האטומים מכל סוג במגיבים שווה לזה שבתוצרים.
מסת המגיבים שווה למסת התוצרים בכל תהליך כימי. (אין החומר נוצר יש מאין ואינו הולך לאיבוד).
חומר המתרכב עם חמצן בתהליך בערה תוך פליטת חום ואור.
טבלה שבה מסודרים היסודות על פי המספר האטומי והתכונות שלהם.
הפיכת גוף נייטרלי לגוף טעון במטען חשמלי על ידי הוספה או הרחקה של אלקטרונים.
אטום שבו מספר האלקטרונים שונה ממספר הפרוטונים. אטום טעון נקרא יון (מיוונית = נודד).
אטום שבו מספר האלקטרונים קטן ממספר הפרוטונים.
41. יון שלילי
אטום שבו מספר האלקטרונים גדול ממספר הפרוטונים.
חומר שאי אפשר לפרקו לחומרים אחרים, כי הוא בנוי מסוג אחד של אטומים.
*292*
משפחה של חומרים המורכבים מהיסודות פחמן, מימן וחמצן, יש בהם אטום חמצן ואטום מימן קשורים יחד (OH).
לכוהלים תכונות משותפות: הם נוזליים, בעלי ריח חריף ודליקים. חלקם נוצרים בתהליך תסיסה.
חומר המשנה את צבעו במגע עם חומצה או בסיס (ראה "בוחן"): בחומצה צבעו אדום, בבסיס צבעו כחול.
חומר שאינו סוגר מעגל חשמלי (חומר המתנגד במידה רבה להעברת זרם חשמלי).
מכשיר הפותח את המעגל החשמלי, כאשר עוצמת הזרם גדולה מזו שהמעגל החשמלי בנוי לשאת. קיים מבטח פשוט הנקרא נתיך, ויש מבטח חדיש הנקרא מבטח חצי אוטומטי.
מכשיר המודד את עוצמתו של הזרם החשמלי.
חומר הסוגר מעגל חשמלי (חומר שדרכו יכול לעבור זרם חשמלי).
תכונה של חומר, המציינת את מידת ההולכה של זרם, כאשר מחברים את החומר במעגל חשמלי סגור (ככל שהמוליכות טובה יותר, כך הזרם העובר במעגל גדול יותר).
מספר מוגדר של אטומים הקשורים בקשרים כימיים.
בגזים אצילים זו מולקולה הבנויה מאטום יחיד. ביסודות אל-מתכתיים אחרים בנויות המולקולות מ-2 אטומים או יותר.
מולקולה הבנויה משני אטומים או יותר של יסודות שונים.
*293*
"אבן הבניין" של פולימר (מונו - אחד, מר - יחידת מבנה).
(דינאמו, גנרטור) מכשיר לייצור זרם חשמלי. בנוי מגלגל הנעה, סליל נחושת, מבודד ומגנט.
מספר האלקטרונים העודפים או מספר האלקטרונים החסרים בהשוואה למספר האלקטרונים שבאטום נייטרלי.
תרכובת המורכבת מיסוד מתכתי ומיסוד אל-מתכתי שאינו חמצן. סתירה בין חומצה לבסיס יוצרת מים ומלח.
מספר הפרוטונים שבגרעין האטום של היסוד.
רצף של מוליכים ומקור זרם המחוברים ביניהם. מאפשר העברת זרם חשמלי.
מתקבל כאשר אין רצף של מוליכים או מקור זרם במעגל החשמלי.
ראו סוללה, דינאמו.
מנגנון הפותח מעגל חשמלי, כאשר מחובר אליו מכשיר חשמלי מחשמל. מכשיר כזה מגן מפני התחשמלות.
קבוצה של יסודות הדומים בתכונותיהם. הם מופיעים בטור אחר בטבלה המחזורית.
מכשיר המאפשר פתיחה וסגירה של מעגל חשמלי.
*294*
יסוד בעל תכונות אופייניות כמו: מבריק, ניתן לריקוע ומוליך היטב זרם חשמלי וחום. רוב המתכות מוצקות בטמפרטורת החדר.
משפחה כימית של יסודות מתכתיים, רובם מוצקים בטמפרטורת החדר, רכים, פעילים מאוד. עם משפחה זו נמנים היסודות הבאים: ליתיום, נתרן, אשלגן, רובידיום, צזיום ופרנציום.
חלקיק חסר מטען חשמלי. מהווה חלק מגרעין האטום.
מספר הנייטרונים בדרך כלל שווה למספר הפרוטונים בגרעין או גדול ממנו.
פולימר סינתטי (ראו פולימר).
אינדיקטור למים.
נייר קובלט כלורי כחול + מים - נייר קובלט כלורי ורוד.
חוט שבמבטח החשמלי הפשוט. בדרך כלל החוט דק מאוד, בעל התנגדות גדולה יותר משל מרכיבי המעגל האחרים. הוא מתחמם יותר בעת מעבר הזרם וניתך ראשון אם עוצמת הזרם עולה מעל למותר.
מקור זרם חשמלי המאפשר קיומו של זרם חשמלי במעגל, הודות לתהליכים כימיים המתרחשים בתוכו.
אות אחת או שתיים משמו הלועזי של היסוד. לפעמים מוזכר בשם "סמל היסוד".
תהליך אכסותרמי שבו מגיבה חומצה עם בסיס, ונוצרים מים ומלח.
מצב שבו עובר בנתיך זרם בעוצמה גדולה בהרבה מהמותר. נגרם בגלל הפעלה בו זמנית של מכשירי חשמל רבים.
*295*
תרכובת הבנויה משרשרות של מולקולות ענקיות. שרשרות אלו מורכבות מיחידות מבנה קטנות - המונומרים. ישנם פולימרים טבעיים כמו: עמילן, חלבון, גומי וכר, וישנם פולימרים סינתטיים כגון: ניילון ועוד.
תרכובת הבנויה מאטומי פחמן ומימן.
תהליך כימי שבו מולקולות קטנות (מונומרים) מתקשרות יחד לשרשרות ענקיות ויוצרות פולימר.
תהליך כימי שבו מתפרקת תרכובת למספר חומרים.
אחד המרכיבים של גרעין האטום. בעל מטען חשמלי חיובי.
פעולה המביאה להפיכת גוף טעון במטען חשמלי לגוף, שאינו טעון מטען חשמלי.
מכשיר חשמלי.
ירידה פתאומית בהתנגדות במעגל החשמלי. הירידה יכולה להיגרם ממגע בין מוליכים שבידודם נקרע.
מקלון עץ דק הבוער בלא להבה.
ראה בערה.
כוח משיכה המקרב שני אטומים זה לזה וגורם להם להישאר קרובים.
*296*
פעולת הרחקה של אטומים הקשורים זה לזה בקשר כימי. פעולה זו מלווה בקליטת חום.
התחברות אטומים זה לזה בקשר כימי כתוצאה מכוחות משיכה הקיימים ביניהם. יצירת קשר כימי מלווה בשחרור אנרגיה בצורת חום.
תהליך שבו נוצרים חומרים חדשים. בתהליך הכימי ניתקים קשרים בין אטומים ונוצרים קשרים חדשים.
תופעה חשמלית הנגרמת על ידי מטען חשמלי נייח (סטטי), הנמצא על גבי מבדד או על גבי מוליך המבודד מסביבתו.
תורה האומרת שחומרים בנויים מאטומים.
תרכובת הבנויה מיסוד כלשהו וחמצן.
תרכובת הבנויה מיסוד אל-מתכתי וחמצן.
תרכובת הבנויה מיסוד מתכתי וחמצן.
סוג של תערובת המתקבלת מערבוב שני חומרים או יותר, שלפחות אחד מהם הוא נוזל. הנוזל הוא הממס והחומרים בתוכו הם המומס.
תהליך של פירוק סוכר על ידי שמרים. תוצרי הפירוק הם כוהל ופחמן דו-חמצני.
*297*
-
*299*
*297*
השם בעברית | המספר האטומי | הסימן הכימי | השם באנגלית | שנת הגילוי |
אבץ | 30 | Zn | Zinc | 1400 |
אוסמיום | 76 | Os | Osmium | 1804 |
אורניום | 92 | U | Uranium | 1789 |
איטרביום | 70 | Yb | Ytterbium | 1878 |
איטריום | 39 | Y | Yttrium | 1794 |
איינשטיניום | 99 | Es | Einsteiniuim | 1952 |
אינדיום | 49 | In | Indium | 1863 |
אירופיום | 63 | Eu | Europium | 1896 |
אירידיום | 77 | Ir | Iridium | 1804 |
אלומיניום | 13 | Al | Aluminum | 1825 |
אמריציום | 95 | Am | Americium | 1944 |
אנטימון | 51 | Sb | Antimony | 1450 |
אסטטין | 85 | At | Astatine | 1940 |
אקטיניום | 89 | Ac | Actinium | 1899 |
ארביום | 68 | Er | Erbium | 1843 |
ארגון | 18 | Ar | Argon | 1894 |
ארסן | 33 | As | Arsenic | 1649 |
אשלגן | 19 | K | Potassium | 1807 |
בדיל | 50 | Sn | Tin | בעת העתיקה |
בור | 5 | B | Boron | 1808 |
ביסמוט | 83 | Bi | Bismuth | 1739 |
ברום | 35 | Br | Bromine | 1826 |
ברזל | 26 | Fe | Iron | בעת העתיקה |
בריום | 56 | Ba | Barium | 1808 |
בריליום | 4 | Be | Beryllium | 1828 |
ברקליום | 97 | Bk | Berkelium | 1949 |
גדוליניום | 64 | Gd | Gadolinium | 1880 |
גליום | 31 | Ga | Gallium | 1875 |
גפרית | 16 | S | Sulfur | בעת העתיקה |
גרמניום | 32 | Ge | Germanium | 1886 |
דיספרוסיום | 66 | Dy | Dysprosium | 1886 |
הולמיום | 67 | Ho | Holmium | 1878 |
הליום | 2 | He | Helium | 1895 |
הפניום | 72 | Hf | Hafnium | 1922 |
ונדיום | 23 | V | Vanadium | 1830 |
זהב | 79 | Au | Gold | בעת העתיקה |
זירקוניום | 40 | Zr | Zirconium | 1789 |
זרחן | 15 | P | Phosphorus | 1669 |
חמצן | 8 | O | Oxygen | 1774 |
חנקן | 7 | N | Nitrogen | 1772 |
טונגסטן | 74 | W | Tungsten | 1783 |
טיטניום | 22 | Ti | Titanium | 1791 |
טכנציום | 43 | Tc | Technetium | 1782 |
טלוריום | 52 | Te | Tellurium | 1782 |
טנטל | 73 | Ta | Tantalum | 1802 |
טרביום | 65 | Tb | Terbium | 1843 |
יוד | 53 | I | Iodine | 1811 |
כלור | 17 | Cl | Chlorine | 1774 |
כסנון | 54 | Xe | Xenon | 1898 |
כסף | 47 | Ag | Silver | בעת העתיקה |
כספית | 80 | Hg | Mercury | בעת העתיקה |
כרום | 24 | Cr | Chromium | 1798 |
לוטציום | 71 | Lu | Lutetium | 1907 |
לורנציום | 103 | Lr | Lawrencium | 1961 |
ליתיום | 3 | Li | Lithium | 1817 |
לנתן | 57 | La | Lanthanum | 1839 |
מגנזיום | 12 | Mg | Magnesium | 1829 |
מוליבדן | 42 | Mo | Molybdenum | 1782 |
מימן | 1 | H | Hydrogen | 1766 |
מנגן | 25 | Mn | Manganese | 1774 |
מנדלביום | 101 | Md | Mendelevium | 1955 |
נובליום | 102 | No | Nobelium | 1957 |
נחושת | 29 | Cu | Copper | בעת העתיקה |
ניאודימיום | 60 | Nd | Neodymium | 1885 |
ניאון | 10 | Ne | Neon | 1898 |
ניוביום | 41 | Nb | Niobium | 1801 |
ניקל | 28 | Ni | Nickel | 1751 |
נפטוניום | 93 | Np | Neptunium | 1940 |
נתרן | 11 | Na | Sodium | 1807 |
סטרונציום | 38 | Sr | Strontium | 1808 |
סידן | 20 | Ca | Calcium | 1808 |
סלן | 34 | Se | Selenium | 1817 |
סמריום | 62 | Sm | Samarium | 1879 |
סקנדיום | 21 | Sc | Scandium | 1879 |
עופרת | 82 | Pb | Lead | בעת העתיקה |
פולוניום | 84 | Po | Polonium | 1898 |
פחמן | 6 | C | Carbon | בעת העתיקה |
פלדיום | 46 | Pd | Palladium | 1803 |
פלואור | 9 | F | Fluorine | 1771 |
פלוטוניום | 94 | Pu | Plutonium | 1940 |
פלטינה | 78 | Pt | Platinum | 1735 |
פרוטאקטיניום | 91 | Pa | Protactinium | 1917 |
פרומתיום | 61 | Pm | Promethium | 1947 |
פרמיום | 100 | Fm | Fermium | 1952 |
פרנציום | 87 | Fr | Frnacium | 1939 |
פרסאודימיום | 59 | Pr | Praseodymium | 1885 |
צורן | 14 | Si | Silicon | 1823 |
צסיום | 55 | Cs | Cesium | 1860 |
צריום | 58 | Ce | Cerium | 1803 |
קדמיום | 48 | Cd | Cadmium | 1817 |
קובלט | 27 | Co | Cobalt | 1742 |
קיוריום | 96 | Cm | Curium | 1944 |
קליפורניום | 98 | Cf | Californium | 1950 |
קריפטון | 36 | Kr | Krypton | 1898 |
רדון | 86 | Rn | Radon | 1900 |
רדיום | 88 | Ra | Radium | 1898 |
רובדיום | 37 | Rb | Rubidium | 1861 |
רודיום | 45 | Rh | Rhodium | 1804 |
רותניום | 44 | Ru | Ruthenium | 1844 |
רניום | 75 | Re | Rhenium | 1925 |
תוליום | 69 | Tm | hulium | 1879 |
תוריום | 90 | Th | Thorium | 1828 |
תליום | 81 | Tl | Thallium | 1861 |
*300*
*300*
1 - H - מימן | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 2 - He - הליום |
3 - Li - ליתיום | 4 - Be - בריליום | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 5 - B - בור | 6 - C - פחמן | 7 - N - חנקן | 8 - O - חמצן | 9 - F - פלואור | 10 - Ne - ניאון |
11 - Na - נתרן | 12 - Mg - מגנזיום | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | 13 - Al - אלומניום | 14 - Si - צורן | 15 - P - זרחן | 16 - S - גופרית | 17 - Cl - כלור | 18 - Ar - ארגון |
19 - K - אשלגן | 20 - Ca - סידן | 21 - Sc - סקנדיום | 22 - Ti - טיטניום | 23 - V - ונדיום | 24 - Cr - כרום | 25 - Mn - מנגן | 26 - Fe - ברזל | 27 - Co - קובלט | 28 - Ni - ניקל | 29 - Cu - נחושת | 30 - Zn - אבץ | 31 - Ga - גאליום | 32 - Ge - גרמניום | 33 - As - ארסן | 34 - Se - סלניום | 35 - Br - ברום | 36 - Kr - קריפטון |
37 - Rb - רובידיום | 38 - Sr - סטרונציום | 39 - Y - איטיריום | 40 - Zr - זירקוניום | 41 - Nb - ניאוביום | 42 - Mo - מולבידן | 43 - Tc - טכנציום | 44 - Ru - רותיניום | 45 - Rh - רודיום | 46 - Pd - פלדיום | 47 - Ag - כסף | 48 - Cd - קדמיום | 49 - In - אינדיום | 50 - Sn - בדיל | 51 - Sb - אנטימון | 52 - Te - טלור | 53 - I - יוד | 54 - Xe - קסנון |
55 - Cs - צזיום | 56 - Ba - באריום | 57-71 - ראה - למטה | 72 - Hf - הפניום | 73 - Ta - טנטליום | 74 - W - טונגסטן | 75 - Re - רניום | 76 - Os - אוסמיום | 77 - Ir - אירידיום | 78 - Pt - פלטינה | 79 - Au - זהב | 80 - Hg - כספית | 81 - Tl - תליום | 82 - Pb - עופרת | 83 - Bi - ביסמוט | 84 - Po - פולניום | 85 - At - אסטטין | 86 - Rn - ראדון |
87 - Fr - פרנציום | 88 - Ra - רדיום | 89-103 - ראה - למטה | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק |
תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק | תא ריק |
תא ריק | תא ריק | 57 - La - לנתן | 58 - Ce - צריום | 59 - Pr - פרסאודימיום | 60 - Nd - ניאודמיום | 61 - Pm - פרומתיום | 62 - Sm - סמריום | 63 - Eu - אירופיום | 64 - Gd גדוליניום | 65 - Tb - טרביום | 66 - Dy - דיספרוסיום | 67 - Ho - הולמיום | 68 - Er - ארביום | 69 - Tm - תולום | 70 - Yb - איטרביום | 71 - Lu - לוטציום | תא ריק |
תא ריק | תא ריק | 89 - Ac - אקטיניום | 90 - Th - תוריום | 91 - Pa - פרואקטיניום | 92 - U - אורניום | 93 - Np - נפטוניום | 94 - Pu - פלוטוניום | 95 - Am - אמרציום | 96 - Cm - קיוריום | 97 - Bk - ברקליום | 98 - Cf - קליפורניום | 99 - Es - אנשטיניום | 100 - Fm - פרמיום | 101 - Md - מנדלביום | 102 - No - נובליום | 103 - Lr - לורנציום) | תא ריק |
סוף הספר